Stereoizomeria - Stereoisomerism
W stereochemii , stereoizomerii lub izomerii przestrzennej , to forma izomerii , w których cząsteczki mają ten sam wzór cząsteczkowy, i sekwencji związanych atomów (skład), ale różnią się pod względem trójwymiarowych orientacji ich atomów w przestrzeni. Kontrastuje to z izomerami strukturalnymi , które mają ten sam wzór cząsteczkowy, ale połączenia wiązań lub ich kolejność jest inna. Z definicji cząsteczki, które są względem siebie stereoizomerami, reprezentują ten sam izomer strukturalny.
Enancjomery
Enancjomery , znane również jako izomery optyczne , to dwa stereoizomery, które są powiązane ze sobą odbiciem: są to swoje lustrzane odbicia , których nie można nakładać. Makroskopowym odpowiednikiem tego są ludzkie ręce. Każde centrum stereogeniczne w jednym ma odwrotną konfigurację w drugim. Dwa związki, które są dla siebie enancjomerami, mają te same właściwości fizyczne, z wyjątkiem kierunku, w którym skręcają światło spolaryzowane i sposobu, w jaki oddziałują z różnymi izomerami optycznymi innych związków. W rezultacie różne enancjomery związku mogą mieć zasadniczo różne efekty biologiczne. Czyste enancjomery wykazują również zjawisko aktywności optycznej i mogą być rozdzielone tylko przy użyciu czynnika chiralnego . W naturze występuje tylko jeden enancjomer większości chiralnych związków biologicznych, takich jak aminokwasy (z wyjątkiem glicyny , która jest achiralna). Związek optycznie czynny ma dwie formy: formę D -(+) i formę L -(-).
Diastereoizomery
Diastereoizomery są stereoizomerami niepowiązanymi przez operację odbicia. Nie są swoimi lustrzanymi odbiciami. Należą mezo związki , cis - trans izomerów , izomery EZ i nie enancjomerycznych izomery optyczne . Diastereoizomery rzadko mają takie same właściwości fizyczne. W przykładzie pokazanym poniżej, forma mezo kwasu winowego tworzy parę diastereomeryczną z kwasami lewo i dekstrowinowym, które tworzą parę enancjomeryczną.

|

|
|
|
(naturalny) kwas winowy kwas |
kwas D -(-)-winowy kwas |
kwas mezo-winowy |
|
(1:1) kwas |
||
D - i L - etykietowanie izomerów powyżej, nie jest taka sama, jak w D - i l - etykietowanie częściej widoczne, wyjaśnienie, dlaczego te mogą odwrócony do tych znanych z tylko ostatnią konwencję nazewnictwa.
Izomeria cis-trans i EZ
Stereoizomeria dotycząca wiązań podwójnych powstaje, ponieważ rotacja wokół wiązania podwójnego jest ograniczona, utrzymując podstawniki nieruchome względem siebie. Jeśli dwa podstawniki na co najmniej jednym końcu podwójnego wiązania, są takie same, to nie ma stereoizomer a wiązanie podwójne znajduje się stereochemiczne, na przykład propylen, CH 3 CH = CH 2 , w którym dwa podstawniki na jednym końcu oznacza H .
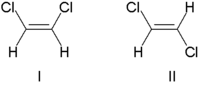
Tradycyjnie stereochemię wiązań podwójnych opisywano jako cis (łac. po tej stronie) lub trans (łac. poprzek), w odniesieniu do względnej pozycji podstawników po obu stronach wiązania podwójnego. Najprostsze przykłady cis - trans izomerii są 1,2-dipodstawione ethenes jak w dichloroetenie (C 2 H 2 Cl 2 ) izomery poniżej.
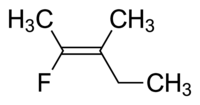
Cząsteczka I to cis -1,2-dichloroeten, a cząsteczka II to trans -1,2-dichloroeten. Ze względu na sporadyczne niejasności, IUPAC przyjął bardziej rygorystyczny system, w którym podstawnikom na każdym końcu wiązania podwójnego przypisuje się pierwszeństwo na podstawie ich liczby atomowej . Jeśli podstawniki o wysokim priorytecie znajdują się po tej samej stronie wiązania, przypisuje się mu Z (niem. zusammen razem). Jeśli są po przeciwnych stronach, jest to E (niem. entgegen , przeciwnie). Ponieważ chlor ma większą liczbę atomową niż wodór, jest to grupa o najwyższym priorytecie. Używając tej notacji do nazwania przedstawionych powyżej cząsteczek, cząsteczka I to (Z)-1,2-dichloroeten, a cząsteczka II to (E)-1,2-dichloroeten. Nie jest tak, że Z i cis lub E i trans są zawsze wymienne. Rozważ następujący fluorometylopenten:
Właściwa nazwa tej cząsteczki to albo trans -2-fluoro-3-metylopent-2-en, ponieważ grupy alkilowe tworzące łańcuch szkieletowy (tj. metyl i etyl) znajdują się w poprzek podwójnego wiązania od siebie, lub (Z) -2-fluoro-3-metylopent-2-en, ponieważ grupy o najwyższym priorytecie po każdej stronie wiązania podwójnego znajdują się po tej samej stronie wiązania podwójnego. Fluoro jest grupą o najwyższym priorytecie po lewej stronie wiązania podwójnego, a etyl jest grupą o najwyższym priorytecie po prawej stronie cząsteczki.
Terminy cis i trans są również używane do opisania względnej pozycji dwóch podstawników w pierścieniu; cis jeśli po tej samej stronie, w przeciwnym razie trans .
Konkurenci
Izomeria konformacyjna jest formą izomerii, która opisuje zjawisko cząsteczek o tym samym wzorze strukturalnym, ale o różnych kształtach z powodu obrotów wokół jednego lub więcej wiązań. Różne konformacje mogą mieć różne energie, zazwyczaj mogą się wzajemnie przekształcać i bardzo rzadko są izolowalne. Na przykład cykloheksan może występować w wielu różnych konformacjach, w tym w konformacji krzesła i konformacji łodzi, ale w przypadku samego cykloheksanu nigdy nie można ich rozdzielić. Konformacja łodzi reprezentuje maksimum energii na trasie konformacyjnej między dwiema równoważnymi formami krzesła; jednak nie reprezentuje stanu przejściowego dla tego procesu, ponieważ istnieją ścieżki o niższej energii.
Istnieje kilka cząsteczek, które można wyizolować w kilku konformacjach, ze względu na duże bariery energetyczne pomiędzy różnymi konformacjami. 2,2',6,6'-tetrapodstawione bifenyle mogą pasować do tej ostatniej kategorii.
Anomers
Anomeria jest tożsamością dla struktur z pojedynczym wiązaniem pierścieniowym, w których „cis” lub „Z” i „trans” lub „E” (izomeria geometryczna) muszą nazwać podstawienia na atomie węgla, który również wykazuje tożsamość chiralności; więc anomery mają atomy węgla, które mają izomerię geometryczną i izomerię optyczną ( enancjomeryzm ) na jednym lub więcej atomach węgla pierścienia. Anomery są nazywane „alfa” lub „aksjalne” i „beta” lub „równikowe”, gdy zastępują cykliczną strukturę pierścieniową, która ma pojedyncze wiązania między atomami węgla pierścienia, na przykład grupę hydroksylową, grupę metylohydroksylową, grupę metoksylową lub inną grupę piranozową lub furanozową, które są typowymi podstawieniami pojedynczego wiązania, ale nie ograniczają się do nich. Osiowa izomeria geometryczna będzie prostopadła (90 stopni) do płaszczyzny odniesienia, a równikowa będzie znajdować się w odległości 120 stopni od wiązania osiowego lub odchylić się o 30 stopni od płaszczyzny odniesienia.
atropoizomery
Atropoizomery są stereoizomerami wynikającymi z utrudnionej rotacji wokół pojedynczych wiązań, gdzie steryczna bariera naprężenia dla rotacji jest wystarczająco wysoka, aby umożliwić izolację konformerów.
Więcej definicji
- Konfiguracyjny stereoizomeru stanowi stereoizomer z cząsteczką odniesienia, ma konfigurację przeciwną w stereocentrum (np R vs S- lub E- vs Z- ). Oznacza to, że izomery konfiguracyjne można przekształcać wzajemnie tylko przez zerwanie wiązań kowalencyjnych ze stereocentrum, na przykład przez odwrócenie konfiguracji niektórych lub wszystkich stereocentrów w związku.
- Epimer jest diastereoizomer że ma konfigurację przeciwną tylko przy jednej z sterycznych.
Zasada Le Bel-van't Hoff
Reguła Le Bel-van't Hoffa mówi, że dla struktury z n asymetrycznymi atomami węgla, możliwe jest maksymalnie 2 n różnych stereoizomerów. Przykładowo, D -glukoza jest aldoheksozy i ma wzór C 6 H 12 O 6 . Cztery z sześciu atomów węgla są stereogeniczne, co oznacza, że D- glukoza jest jednym z 2 4 =16 możliwych stereoizomerów.