Izomer strukturalny - Structural isomer
W chemii , A Strukturalny izomer (lub izomeru konstytucyjnej w IUPAC Nomenclature) o związek jest inny związek, którego cząsteczka zawiera taką samą liczbę atomów każdego elementu, ale odmienne logicznie wiązania pomiędzy nimi. Termin metamer był wcześniej używany do tego samego pojęcia.
Na przykład butanol H.
3 C - (CH
2 )
3 –OH, eter metylowo-propylowy H.
3 C - (CH
2 )
2 –O– CH
3 i eter dietylowy ( H.
3 C - CH
2 -) 2 O ma ten sam wzór cząsteczkowy C.
4 H.
10 O, ale są to trzy różne izomery strukturalne.
Koncepcja dotyczy również jonów wieloatomowych o tym samym ładunku całkowitym. Klasycznym przykładem jest jon cyjanianowy O = C = N - i jon piorunianowy C - ≡N + O - . Rozszerza się również na związki jonowe, tak że (na przykład) cyjanian amonu [ NH
4 ] + [O = C = N] - i mocznik ( H
2 N -) 2 C = O są uważane za izomery strukturalne, podobnie jak mrówczan metyloamoniowy [ H
3 C - NH
3 ] + [ HCO
2 ] - i octan amonu [ NH
4 ] + [ H
3 C - CO
2 ] - .
Izomeria strukturalna jest najbardziej radykalnym rodzajem izomerii . Jest przeciwieństwem stereoizomerii , w której atomy i schemat wiązania są takie same, ale tylko względne rozmieszczenie przestrzenne atomów jest inne. Przykładami tych ostatnich są enancjomery , których cząsteczki są wzajemnymi odbiciami lustrzanymi, oraz wersje cis i trans 2-butenu .
Spośród izomerów strukturalnych, można wyróżnić kilka grup w tym szkieletowych izomerów , izomery pozycyjne (lub regioizomerów ), izomery funkcjonalnych , tautomery i topoisomers strukturalnych .
Izomeria szkieletowa
Szkieletowych izomer związku jest izomerem strukturalnym, który różni się od niego w atomów i wiązań, które są uważane za obejmujące „szkielet” w cząsteczce. W przypadku związków organicznych , takich jak alkany , zwykle oznacza to atomy węgla i wiązania między nimi.
Na przykład, istnieją trzy szkieletowe izomery pentanu : n- pentan (często nazywany po prostu „pentanem”), izopentan (2-metylobutan) i neopentan (dimetylopropan).
|
|

|

|
| n - pentan | Izopentan | Neopentan |
Jeśli szkielet jest acykliczny , jak w powyższym przykładzie, można użyć terminu izomeria łańcuchowa .
Izomeria pozycji (regioizomeria)
Izomery pozycyjne (również izomery pozycyjne lub regioizomery ) są izomerami strukturalnymi, które mogą być postrzegane jako różniące się jedynie pozycją grupy funkcyjnej , podstawnika lub inną cechą struktury „macierzystej”.
Na przykład zastąpienie jednego z 12 atomów wodoru –H przez grupę hydroksylową –OH w macierzystej cząsteczce n- pentanu może dać dowolny z trzech różnych pozycji izomerów:
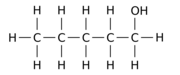
|
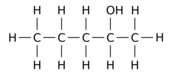
|
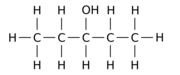
|
| Pentan-1-ol | Pentan-2-ol | Pentan-3-ol |
Izomeria funkcjonalna
Izomery funkcjonalne to izomery strukturalne, które mają różne grupy funkcyjne , co skutkuje znacząco różnymi właściwościami chemicznymi i fizycznymi.
Przykładem jest para propanalu H 3 C – CH 2 –C (= O) -H i aceton H 3 C – C (= O) –CH 3 : pierwsza ma grupę funkcyjną –C (= O) H, która czyni go aldehydem , podczas gdy drugi ma grupę C – C (= O) –C, co czyni go ketonem .
Innym przykładem jest para etanol H 3 C – CH 2 –OH ( alkohol ) i eter dimetylowy H 3 C – O – CH 2 H ( eter ). W przeciwieństwie do tego 1-propanol i 2-propanol są izomerami strukturalnymi, ale nie są izomerami funkcyjnymi, ponieważ mają tę samą istotną grupę funkcyjną ( hydroksyl –OH) i oba są alkoholami.
Oprócz różnych właściwości chemicznych izomery funkcyjne mają zazwyczaj bardzo różne widma w podczerwieni . Widmo w podczerwieni jest w dużej mierze zdeterminowane przez tryby wibracji cząsteczki, a grupy funkcyjne, takie jak hydroksyl i estry, mają bardzo różne tryby wibracji. Tak więc 1-propanol i 2-propanol mają stosunkowo podobne widma w podczerwieni ze względu na grupę hydroksylową, która różni się znacznie od widma eteru metylowo-etylowego.
Izotopomery strukturalne
W chemii zwykle pomija się rozróżnienia między izotopami tego samego pierwiastka. Jednak w niektórych sytuacjach (na przykład w spektroskopii Ramana , NMR lub mikrofalowej ) można traktować różne izotopy tego samego pierwiastka jako różne pierwiastki. W drugim przypadku o dwóch cząsteczkach z taką samą liczbą atomów każdego izotopu, ale o różnych schematach wiązań mówi się, że są izotopomerami strukturalnymi .
Na przykład eten nie miałby żadnych izomerów strukturalnych w pierwszej interpretacji; ale zastąpienie dwóch atomów wodoru ( 1 H) atomami deuteru ( 2 H) może dać dowolny z dwóch izotopomerów strukturalnych (1,1-dideuteroeten i 1,2-dideuteroeten), jeśli oba atomy węgla są tym samym izotopem. Jeżeli, ponadto, dwa atomy węgla są różne izotopy (na przykład, 12 ° C i 13 ° C), nie byłoby trzy różne izotopomerów strukturalnych od 1 13 C 1,1 dideuteroethene będzie się różnić od 1- 13 C-2 ' , 2-dideuteroeten.) I, w obu przypadkach, izotopomer strukturalny 1,2-dideutero występowałby jako dwa izotopery stereo, cis i trans .
Strukturalna równoważność i symetria
Równoważność strukturalna
Jeden mówi, że dwie cząsteczki (w tym jony wieloatomowe) A i B mają tę samą strukturę, jeśli każdy atom A może być sparowany z atomem B tego samego pierwiastka, w sposób jeden do jednego, tak że dla każdego wiązania w A istnieje wiązanie w B tego samego typu między odpowiednimi atomami; i wzajemnie. Wymóg ten dotyczy również wiązań złożonych, które obejmują trzy lub więcej atomów, takich jak zdelokalizowane wiązanie w cząsteczce benzenu i innych związkach aromatycznych.
W zależności od kontekstu, można wymagać, aby każdy atom był sparowany z atomem tego samego izotopu, a nie tylko tego samego pierwiastka.
Można zatem powiedzieć, że dwie cząsteczki są izomerami strukturalnymi (lub, jeśli materia izotopów, izotopomerami strukturalnymi), jeśli mają ten sam wzór cząsteczkowy, ale nie mają takiej samej struktury.
Strukturalna symetria i równoważne atomy
Strukturalną symetrię cząsteczki można zdefiniować matematycznie jako permutację atomów, która wymienia co najmniej dwa atomy, ale nie zmienia struktury cząsteczki. Można zatem powiedzieć, że dwa atomy są strukturalnie równoważne, jeśli istnieje symetria strukturalna, która łączy jeden z drugim.
Tak więc, na przykład, wszystkie cztery atomy wodoru w metanie są strukturalnie równoważne, ponieważ każda ich permutacja zachowa wszystkie wiązania cząsteczki.
Podobnie, wszystkie sześć wodorów etanu ( C.
2 H.
6 ) są strukturalnie równoważne, podobnie jak dwa atomy węgla; ponieważ każdy wodór można zamienić na dowolny inny, albo przez permutację, która zamienia tylko te dwa atomy, albo przez permutację, która zamienia dwa atomy węgla i każdy atom wodoru w jednej grupie metylowej z innym wodorem w drugiej grupie metylowej. Każda operacja zachowuje strukturę cząsteczki. Oznacza to również w przypadku atomy wodoru, cyklopentan , alenowa , 2-butynu , heksametylenotetramina , prismane , cubane , dodekaedran , etc.
Z drugiej strony, nie wszystkie atomy wodoru propanu są równoważne strukturalnie. Sześć atomów wodoru przyłączonych do pierwszego i trzeciego atomu węgla jest równoważnych, jak w etanie, a dwa atomy węgla przyłączone do środkowego węgla są sobie równoważne; ale nie ma równoważności między tymi dwiema klasami równoważności .
Symetria i izomeria pozycyjna
Strukturalne równoważniki między atomami cząsteczki rodzicielskiej zmniejszają liczbę izomerów pozycyjnych, które można uzyskać, zastępując te atomy innym pierwiastkiem lub grupą. Tak więc, na przykład, równoważność strukturalna między sześcioma wodorami etanu C.
2 H.
6 oznacza, że istnieje tylko jeden strukturalny izomer etanolu CH
5 OH , nie 6. Osiem wodorów propanu C.
3 H.
8 są podzielone na dwie strukturalne klasy równoważności (sześć na grupach metylowych i dwie na centralnym atomie węgla); dlatego istnieją tylko dwa pozycyjne izomery propanolu ( 1-propanol i 2-propanol ). Podobnie istnieją tylko dwa izomery pozycyjne butanolu i trzy z pentanolu lub heksanolu .
Zerwanie symetrii przez podstawienia
Po dokonaniu podstawienia w cząsteczce rodzicielskiej, jej symetria strukturalna jest zwykle zmniejszona, co oznacza, że atomy, które były wcześniej równoważne, mogą już takie nie być. Zatem podstawienie dwóch lub więcej równoważnych atomów tym samym pierwiastkiem może wygenerować więcej niż jeden izomer pozycyjny.
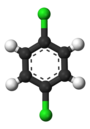
Klasycznym przykładem są pochodne benzenu . Jego sześć atomów wodoru jest strukturalnie równoważnych, podobnie jak sześć atomów węgla; ponieważ struktura nie ulega zmianie, jeśli atomy są permutowane w sposób odpowiadający odwróceniu cząsteczki lub obróceniu jej o wielokrotność 60 stopni. Dlatego zastąpienie dowolnego wodoru chlorem daje tylko jeden chlorobenzen . Jednak po tej zamianie, permutacje atomów, które poruszyły ten wodór, nie są już ważne. Pozostaje tylko jedna permutacja, która odpowiada odwróceniu cząsteczki przy jednoczesnym utrzymaniu stałego chloru. Pięć pozostałych wodorów dzieli się następnie na trzy różne klasy równoważności: ta przeciwna do chloru jest klasą samą w sobie (zwana pozycją para ), dwie najbliższe chloru tworzą inną klasę ( orto ), a pozostałe dwie to trzecia klasa ( meta ). Zatem drugie podstawienie wodoru chlorem może dać trzy izomery pozycyjne: 1,2- lub orto - , 1,3- lub meta - i 1,4- lub para- dichlorobenzen .
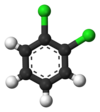
|

|
|
| orto- dichlorobenzen | meta- dichlorobenzen | para- dichlorobenzen |
| 1,2-dichlorobenzen | 1,3-dichlorobenzen | 1,4-dichlorobenzen |
Z tego samego powodu jest tylko jeden fenol (hydroksybenzen), ale trzy benzenodiole ; i jeden toluen (metylobenzen), ale trzy toluole i trzy ksyleny .
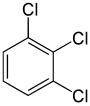
Z drugiej strony, drugie zastąpienie (przez ten sam podstawnik) może zachować lub nawet zwiększyć symetrię cząsteczki, a tym samym może zachować lub zmniejszyć liczbę klas równoważności dla następnej zamiany. Zatem cztery pozostałe wodory w meta- dichlorobenzenie nadal należą do trzech klas, podczas gdy wodory z orto - należą do dwóch, a wodory z para - są znowu równoważne. Mimo to, niektóre z tych 3 + 2 + 1 = 6 podstawień kończą się otrzymaniem tej samej struktury, więc istnieją tylko trzy strukturalnie różne trichlorobenzeny : 1,2,3- , 1,2,4- i 1,3,5- .
|

|

|
| 1,2,3-trichlorobenzen | 1,2,4-trichlorobenzen | 1,3,5-trichlorobenzen |
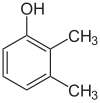
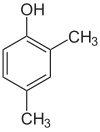
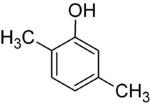
Jeśli podstawniki na każdym etapie są różne, zwykle będzie więcej izomerów strukturalnych. Ksylenol , który jest benzenem z jednym podstawnikiem hydroksylowym i dwoma podstawnikami metylowymi, ma łącznie 6 izomerów:
|
|
|
| 2,3-ksylenol | 2,4-ksylenol | 2,5-ksylenol |

|

|

|
| 2,6-ksylenol | 3,4-ksylenol | 3,5-ksylenol |
Wyliczanie i liczenie izomerów
Wyliczenie lub zliczenie izomerów strukturalnych w ogóle jest trudnym problemem, ponieważ należy wziąć pod uwagę kilka typów wiązań (w tym zdelokalizowanych), struktury cykliczne i struktury, których nie można zrealizować z powodu walencji lub ograniczeń geometrycznych oraz nierozdzielne tautomery.
Na przykład istnieje dziewięć izomerów strukturalnych o wzorze cząsteczkowym C 3 H 6 O, które mają różne wiązania wiązań. Siedem z nich jest stabilnych w powietrzu w temperaturze pokojowej i podano je w poniższej tabeli.
| Związek chemiczny | Struktura molekularna |
Topnienia Temperatura (° C) |
Temperatura wrzenia (° C) |
Komentarz |
|---|---|---|---|---|
| Alkohol allilowy |
|
–129 | 97 | |
| Cyklopropanol |
|
101–102 | ||
| Aldehyd propionowy |
|
–81 | 48 | Tautomeryczny z prop-1-en-1-olem, który ma zarówno postacie stereoizomeryczne cis, jak i trans |
| Aceton |
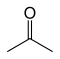
|
–94,9 | 56,53 | Tautomeryczny z propen-2-olem |
| Oksetan |
|
–97 | 48 | |
| Tlenek propylenu |
|
–112 | 34 | Ma dwie formy enancjomeryczne |
| Eter metylowo-winylowy |
|
–122 | 6 |
Dwa izomery strukturalne są tautomerami enolu izomerów karbonylowych (aldehyd propionowy i aceton), ale nie są one stabilne.
Zobacz też
Bibliografia
- ^ „Izomeria konstytucyjna” . Złota Księga IUPAC . IUPAC . Źródło 19 lipca 2018 r .
- ^ Frederick A. Bettelheim, William H. Brown, Mary K. Campbell, Shawn O. Farrell (2009): Wprowadzenie do organiki i biochemii . 752 stron. ISBN 9780495391166
- ^ a b Peter P. Mumba (2018): Useful Principles in Chemistry for Agriculture and Nursing Students , 2nd Edition. 281 stron. ISBN 9781618965288
- ^ a b William F. Bynum, E. Janet Browne, Roy Porter (2014): Słownik historii nauki . 530 stron. ISBN 9781400853410
- ^ Jim Clark (2000). „Structural Isomerism ” w Chemguide , nl
- ^ Poppe, Laszlo; Nagy, Jozsef; Hornyanszky, Gabor; Boros, Zoltan; Mihaly, Nogradi (2016). Stereochemia i synteza stereoselektywna: wprowadzenie . Weinheim, Niemcy: Wiley-VCH. pp. 26–27. ISBN 978-3-527-33901-3 .
- ^ D. Brynn Hibbert, AM James (1987): Macmillan Dictionary of Chemistry . 532 stron. ISBN 9781349188178
- ^ Zdenek Slanina (1986): Współczesna teoria izomerii chemicznej . 254 stron. ISBN 9789027717078
- ^ H. Stephen Stoker (2015): General, Organic, and Biological Chemistry , 7. edycja. 1232 stron. ISBN 9781305686182
- ^ Barry G. Hinwood (1997): Podręcznik naukowy dla zawodów medycznych . 489 stron. ISBN 9780748733774
- ^ Jean-Loup Faulon, Andreas Bender (2010): Podręcznik algorytmów chemoinformatycznych . 454 strony. ISBN 9781420082999
- ^ Podręcznik chemii i fizyki CRC 65th Ed.
