Sól kwasowa - Acid salt
Sole kwaśne to klasa soli, które po rozpuszczeniu w rozpuszczalniku tworzą kwaśny roztwór . Jego powstanie jako substancja ma większą przewodność elektryczną niż czysty rozpuszczalnik. Kwaśnym roztworze tworzą sól kwasu jest podczas częściowego zobojętniania z diprotic lub kwasów polyprotic . Pół zobojętnienie zachodzi z uwagi na pozostały w wymienne wodoru węgla z częściowej dysocjacji słabych kwasów, które nie przereagowały z jonów wodorotlenowych ( OH, - ), aby stworzyć cząsteczkę wody. Sól kwasowa jest związkiem jonowym składającym się z anionu pochodzącego ze słabego kwasu macierzystego i kationu pochodzącego z mocnej zasady macierzystej .
Roztwór kwaśny i przykłady soli kwaśnych
Właściwości kwasowo-zasadowe otrzymanego roztworu z reakcji zobojętniania zależą od pozostałych produktów soli. Sól zawierająca reaktywne kationy ulega hydrolizie, w wyniku której reagują z cząsteczkami wody, powodując deprotonację sprzężonych kwasów.
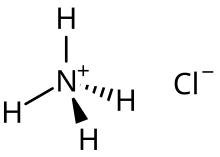
Na przykład, chlorek amonu o kwaśnej soli jest głównym związkiem powstającym w wyniku połowicznej neutralizacji amoniaku w roztworze kwasu solnego:
| Tożsamość: | Wodorosiarczan sodu | Fosforan sodu | Fosforan disodowy |
|---|---|---|---|
| Formuła strukturalna | |||
| Wzór chemiczny |
NaHSO 4 |
NaH 2 PO 4 |
Na 2 HPO 4 |
| Nazwa IUPAC | Wodorosiarczan sodu | Diwodorofosforan sodu | Wodorofosforan disodowy |
| Inna nazwa | |||
| Waga molekularna | 120,054 g / mol | 119,976 g / mol | 141,957 g / mol |
| Opłata formalna | zero | zero | zero |
| Zapach | Bezwonny | Bezwonny | Bezwonny |
| Wygląd | Białe kryształy lub granulki | Biały krystaliczny proszek | Biały, higroskopijny proszek |
| Struktura | Kryształy jednoskośne | Kryształy jednoskośne (bezwodne) | |
| Rozpuszczalność | |||
|
Gęstość |
0,5–1,2 g / cm 3 | 1,7 g / cm 3 | |
|
Rozkład (poprzez ogrzewanie) |
Tworzy węglan sodu, wodę i dwutlenek węgla | Wydziela toksyczne opary fosfotlenków i tlenku sodu | Wydziela toksyczne opary tlenków fosforu i sodu |
| Używa |
Użyj w żywności
Sole kwaśne są często stosowane w żywności jako część środków spulchniających. W tym kontekście sole kwasów określa się jako „kwasy spulchniające”. Typowe kwasy zakwaszające obejmują krem z kamienia nazębnego i fosforan monowapniowy .
Kwaśną sól można zmieszać z solą alkaliczną (taką jak wodorowęglan sodu lub soda oczyszczona) w celu uzyskania proszku do pieczenia, który uwalnia dwutlenek węgla . Środki spulchniające mogą być wolno działające (np. Fosforan glinowo-sodowy ), które reagują po podgrzaniu, lub szybko działające (np. Krem z kamienia nazębnego), które reagują natychmiast w niskich temperaturach. Proszki do pieczenia o podwójnym działaniu zawierają zarówno wolno działające, jak i szybko działające środki spulchniające i reagują w niskich i wysokich temperaturach, zapewniając wzrost zaczynu w trakcie procesu pieczenia.
Fosforan disodowy , Na
2 HPO
4 , jest stosowany w żywności i fosforanie monosodowym NaH
2 PO
4 , jest stosowany w paszach dla zwierząt, pastach do zębów i mleku odparowanym.
Intensywność kwasu
Kwas o wyższej K wartość dominuje nad reakcją chemiczną. Służy jako lepszy wkład protonów ( H + ). Porównanie między K a i K b wskazuje kwasowo-zasadową właściwość otrzymanego roztworu, za pomocą której:
- Roztwór jest kwaśny, jeśli K a > K b . Zawiera większe stężenie jonów H + niż stężenie jonów OH - ze względu na bardziej intensywną hydrolizę kationową w porównaniu z hydrolizą anionów.
- Roztwór jest alkaliczny, jeśli K a < K b . Aniony hydrolizują bardziej niż kationy, powodując nadmierne stężenie jonów OH - .
- Oczekuje się, że rozwiązanie będzie neutralne tylko wtedy, gdy K a = K b .
Innymi możliwymi czynnikami, które mogą zmieniać poziom pH roztworu, są odpowiednie stałe równowagi i dodatkowe ilości dowolnej zasady lub kwasu.
Na przykład, w chlorku amonu roztworu NH +
4 jest głównym czynnikiem wpływającym na kwaśny roztwór. Ma większą wartość K w porównaniu z cząsteczkami wody; K z NH +
4 jest 5,6 x 10 -10 , a K w w H
2 O jest 1,0 × 10 −14 . Zapewnia to jego deprotonację podczas reakcji z wodą i odpowiada za pH poniżej 7 w temperaturze pokojowej. Cl - nie będzie miało powinowactwo do H + ani skłonność do hydrolizy, a jego K b wartość jest bardzo niska ( K b o Cl - jest 7,7 × 10 −21 ).
Hydroliza amonu w temperaturze pokojowej prowadzi do:
Zobacz też
- Sól alkaliczna
- Sól (chemia)
- Oxoacid
- Wodorowęglan sodu
- Wodorosiarczan sodu
- Fosforan disodowy
- Fosforan sodu
Bibliografia





![{\ Displaystyle K _ {\ mathrm {a}} = {\ frac {\ mathrm {[NH_ {3}] [H_ {3} O ^ {+}]}} {\ mathrm {[NH_ {4} ^ {+ }]}}} = {\ frac {K _ {\ mathrm {w}}} {K _ {\ mathrm {b}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5eac34ff25fa376268b6f116d33bf3d00ca7dfab)
![{\ Displaystyle K _ {\ mathrm {a}} = {\ Frac {[1,0 \ times 10 ^ {- 14}]} {[1,8 \ times 10 ^ {- 5}]}} = {5,6} \ times 10 ^ {-10}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/43f0025153c13e4b649bc0ef2c4ea94caefc4c28)