Pozorna własność molowa - Apparent molar property
Oczywiste molowy właściwość z roztworu składników w mieszaninie lub roztworze jest ilość zdefiniowana w celu izolowania wkładu każdego składnika w odniesieniu do nie-idealności mieszaniny . Pokazuje zmianę odpowiedniej właściwości rozwiązania (na przykład volume ), gdy cały ten składnik zostanie dodany do roztworu, na mol dodanego składnika. Jest to opisane jako oczywiste, ponieważ wydaje się, że reprezentuje molową właściwość tego składnika w roztworze , pod warunkiem, że właściwości pozostałych składników roztworu pozostają stałe podczas dodawania. Jednak założenie to często nie jest uzasadnione, ponieważ wartości pozornych właściwości molowych składnika mogą się znacznie różnić od jego właściwości molowych w stanie czystym.
Na przykład objętość roztworu zawierającego dwa składniki zidentyfikowane jako rozpuszczalnik i substancja rozpuszczona wyrażona jest przez
gdzie V 0 to objętość czystego rozpuszczalnika przed dodaniem substancji rozpuszczonej i jej objętość molowa (w tej samej temperaturze i ciśnieniu co roztwór), n 0 to liczba moli rozpuszczalnika, to pozorna objętość molowa substancji rozpuszczonej , oraz n 1 to liczba moli substancji rozpuszczonej w roztworze. Dzieląc tę zależność przez ilość molową jednego składnika można otrzymać zależność między pozorną molową właściwością składnika a stosunkiem mieszania składników.
To równanie służy jako definicja . Pierwszy składnik jest równy objętości tej samej ilości rozpuszczalnika bez substancji rozpuszczonej, a drugi składnik to zmiana objętości po dodaniu substancji rozpuszczonej. można wówczas uznać za objętość molową substancji rozpuszczonej, jeżeli założy się, że objętość molowa rozpuszczalnika nie uległa zmianie w wyniku dodania substancji rozpuszczonej. Jednak to założenie często musi być uważane za nierealistyczne, jak pokazano w poniższych przykładach, a więc jest opisane tylko jako pozorna wartość.
Pozorna ilość molowa może być podobnie zdefiniowana dla składnika zidentyfikowanego jako rozpuszczalnik . Niektórzy autorzy donoszą o pozornych objętościach molowych obu (płynnych) składników tego samego roztworu. Procedurę tę można rozszerzyć na mieszaniny trójskładnikowe i wieloskładnikowe.
Pozorne ilości można również wyrazić za pomocą masy zamiast liczby moli. To wyrażenie daje pozorne określone wielkości, takie jak pozorna objętość właściwa.
gdzie określone ilości są oznaczone małymi literami.
Pozorne (molowe) właściwości nie są stałymi (nawet w danej temperaturze), ale funkcjami składu. Przy nieskończonym rozcieńczeniu pozorna własność molowa i odpowiadająca jej częściowa własność molowa stają się równe.
Niektóre pozorne właściwości molowe, które są powszechnie stosowane, to pozorna entalpia molowa , pozorna molowa pojemność cieplna i pozorna objętość molowa.
Stosunek do molalności
Pozorna (molowa) objętość substancji rozpuszczonej może być wyrażona jako funkcja molowości b tej substancji rozpuszczonej (oraz gęstości roztworu i rozpuszczalnika). Objętość roztworu na mol substancji rozpuszczonej wynosi
Odjęcie objętości czystego rozpuszczalnika na mol substancji rozpuszczonej daje pozorną objętość molową:
Dla większej liczby substancji rozpuszczonych powyższa równość jest modyfikowana średnią masą molową substancji rozpuszczonych tak, jakby były pojedynczą substancją o molalności b T :
- ,
Suma molowości produktów – pozornych objętości molowych substancji rozpuszczonych w ich roztworach dwuskładnikowych jest równa iloczynowi sumy molowości substancji rozpuszczonych i pozornej objętości molowej w trójskładnikowym roztworze wieloskładnikowym.
- ,
Stosunek do proporcji mieszania
Zależność między molowym pozornym składnikiem mieszaniny a molowym stosunkiem zmieszania można uzyskać dzieląc relację definicji
do liczby moli jednego składnika. Daje to następującą zależność:
Stosunek do ilości częściowych (molowych)
Zwróć uwagę na kontrastujące definicje między częściową ilością molową a pozorną ilością molową: w przypadku częściowych objętości molowych , określonych przez częściowe pochodne
- ,
można pisać i tak zawsze się trzyma. Natomiast w definicji pozornej objętości molowej zamiast tego stosuje się objętość molową czystego rozpuszczalnika , którą można zapisać jako
- ,
dla porownania. Innymi słowy, zakładamy, że objętość rozpuszczalnika się nie zmienia i używamy częściowej objętości molowej, w której liczba moli substancji rozpuszczonej wynosi dokładnie zero („objętość molowa”). Tak więc w wyrażeniu definiującym pozorną objętość molową ,
- ,
termin ten przypisywany jest czystemu rozpuszczalnikowi, podczas gdy „pozostały” nadmiar objętości, uważa się, że pochodzi z substancji rozpuszczonej. Przy dużym rozcieńczeniu z , mamy , a więc pozorna objętość molowa i częściowa objętość molowa substancji rozpuszczonej również są zbieżne: .
Ilościowo związek między cząstkowymi własnościami molowymi a pozornymi można wyprowadzić z definicji ilości pozornych i molalności. Dla objętości,
Związek ze współczynnikiem aktywności elektrolitu i jego liczbą powłok solwatacyjnych
Stosunek r a między pozorną objętością molową rozpuszczonego elektrolitu w stężonym roztworze a objętością molową rozpuszczalnika (wody) można powiązać ze składnikiem statystycznym współczynnika aktywności elektrolitu i jego liczby powłoki solwatacyjnej h :
,
gdzie ν jest liczbą jonów powstałych w wyniku dysocjacji elektrolitu, a b jest molowością jak wyżej.
Przykłady
Elektrolity
Pozorna objętość molowa soli jest zwykle mniejsza niż objętość molowa soli w stanie stałym. Na przykład, stałe NaCl o objętości 27 cm 3 na mol, ale widoczna objętość molowa w niskich stężeniach jest tylko 16,6 ml / mol. W rzeczywistości niektóre wodnych elektrolitów negatywne widocznych ilości molowe: NaOH, -6,7, LiOH -6.0 i Na 2 CO 3 -6,7 cm 3 / mol. Oznacza to, że ich roztwory w danej ilości wody mają mniejszą objętość niż ta sama ilość czystej wody. (Efekt jest jednak niewielki.) Fizycznym powodem jest to, że pobliskie cząsteczki wody są silnie przyciągane przez jony, przez co zajmują mniej miejsca.
Alkohol
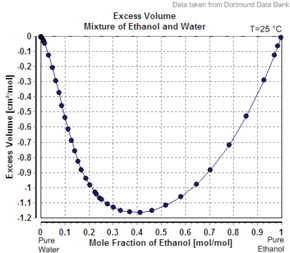
Innym przykładem pozornej objętości molowej drugiego składnika jest mniejsza niż jego objętość molowa jako czystej substancji, jest przypadek etanolu w wodzie. Na przykład, przy 20 procentach masowych etanolu, roztwór ma objętość 1,0326 litra na kg w temperaturze 20°C, podczas gdy czysta woda ma 1,0018 l/kg (1,0018 cm3/g). Pozorna objętość dodanego etanolu wynosi 1,0326 l – 0,8 kg x 1,0018 l/kg = 0,2317 l. Liczba moli etanolu wynosi 0,2 kg / (0,04607 kg/mol) = 4,341 mola, a więc pozorna objętość molowa wynosi 0,2317 l/4,341 mol = 0,0532 l/mol = 53,2 cm3/mol (1,16 cm3/g). Jednak czysty etanol ma w tej temperaturze objętość molową 58,4 cm3/mol (1,27 cm3/g).
Gdyby rozwiązanie było idealne , jego objętość byłaby sumą niezmieszanych składników. Objętość 0,2 kg czystego etanolu to 0,2 kg x 1,27 l/kg = 0,254 l, a objętość 0,8 kg czystej wody to 0,8 kg x 1,0018 l/kg = 0,80144 l, więc idealna objętość roztworu wynosiłaby 0,254 l + 0,80144 L = 1,055 l. Nieidealność roztworu odzwierciedla niewielki spadek (około 2,2%, 1,0326 zamiast 1,055 l/kg) objętości połączonego układu po zmieszaniu. Gdy procent etanolu wzrasta do 100%, pozorna objętość molowa wzrasta do objętości molowej czystego etanolu.
Elektrolit – układy nieelektrolitowe
Pozorne ilości mogą podkreślać interakcje w układach elektrolit – nieelektrolity, które wykazują interakcje takie jak wsalanie i wysalanie , ale także dają wgląd w interakcje jon-jon, zwłaszcza poprzez ich zależność od temperatury.
Mieszaniny lub roztwory wieloskładnikowe
W przypadku roztworów wieloskładnikowych pozorne właściwości molowe można określić na kilka sposobów. Dla przykładu dla objętości trójskładnikowego (3-składnikowego) roztworu z jednym rozpuszczalnikiem i dwoma substancjami rozpuszczonymi nadal byłoby tylko jedno równanie , które jest niewystarczające do wyznaczenia dwóch pozornych objętości. (Jest to przeciwieństwo częściowych właściwości molowych , które są dobrze zdefiniowanymi właściwościami intensywnymi materiałów, a zatem jednoznacznie zdefiniowanymi w układach wieloskładnikowych. Na przykład częściowa objętość molowa jest określona dla każdego składnika i jako .)
Jeden opis trójskładnikowych roztworów wodnych uwzględnia tylko średnią ważoną pozorną objętość molową substancji rozpuszczonych, określoną jako
- ,
gdzie jest objętość roztworu i objętość czystej wody. Ta metoda może być rozszerzona dla mieszanin zawierających więcej niż 3 składniki.
- ,
Suma molowości produktów – pozornych objętości molowych substancji rozpuszczonych w ich roztworach dwuskładnikowych jest równa iloczynowi sumy molowości substancji rozpuszczonych i pozornej objętości molowej w trójskładnikowym roztworze wieloskładnikowym.
- ,
Inną metodą jest potraktowanie układu trójskładnikowego jako pseudobinarnego i zdefiniowanie pozornej objętości molowej każdej substancji rozpuszczonej w odniesieniu do układu binarnego zawierającego oba inne składniki: wodę i drugą substancję rozpuszczoną. Pozorne objętości molowe każdej z dwóch substancji rozpuszczonych wynoszą zatem
- oraz
Pozorna objętość molowa rozpuszczalnika wynosi:
Jest to jednak niezadowalający opis właściwości objętościowych.
Pozorna objętość molowa dwóch składników lub substancji rozpuszczonych uważane za jeden pseudocomponent lub nie powinno być mylone z ilości częściowych binarnych mieszanin z jednego wspólnego elementu V ij , V jk który miesza się w określonym stosunku mieszania tworzą pewien mieszaninę trójskładnikową V lub V ijk .
Oczywiście objętość dopełniacza składnika w stosunku do innych składników mieszaniny można zdefiniować jako różnicę między objętością mieszaniny a objętością podmieszanki binarnej danej kompozycji, np.:
Zdarzają się sytuacje, w których nie ma rygorystycznego sposobu na określenie, który rozpuszczalnik jest rozpuszczalnikiem, a który rozpuszczalny, jak w przypadku mieszanin płynnych (np. wody i etanolu), które mogą rozpuszczać się w postaci stałej, jak cukier lub sól, a które nie. W tych przypadkach pozorne właściwości molowe mogą i muszą być przypisane wszystkim składnikom mieszaniny.
Zobacz też
- Frakcja objętości
- Idealne rozwiązanie
- Zwykłe rozwiązanie
- Zmiana entalpii roztworu
- Entalpia mieszania
- Projekt bloku
- Ciepło rozcieńczania
- Energia nawodnienia
- Numer transportowy jonów
- Solwatacja powłoki
- Częściowa własność molowa
- Nadmiar molowy
- Solenie w
- Działka trójargumentowa
- Aktywność termodynamiczna
Bibliografia
- ^ To oznaczenie jest arbitralne. W przypadku mieszanin dwóch cieczy każda z nich może być opisana jako rozpuszczalnik. W przypadku mieszanin cieczy i ciała stałego ciecz jest zwykle identyfikowana jako rozpuszczalnik, a ciało stałe jako substancja rozpuszczona, ale teoria jest nadal ważna, jeśli etykiety są odwrócone.
- ^ Rock, Peter A., Chemical Thermodynamics, MacMillan 1969, s.227-230 dla mieszanin woda-etanol.
- ^ HH Ghazoyan i Sz. A. Markarian (2014) GĘSTOŚCI, NADMIAR OBJĘTOŚCI MOLOWYCH I CZĘŚCIOWYCH OBJĘTOŚCI MOLOWYCH DLA UKŁADÓW BINARNYCH METANOLU LUB ETANOLU Z METANOLU LUB ETANOLEM W ZAKRESIE TEMPERATUR 298,15 – 323,15 K POSTĘPOWANIE UNIWERSYTETU PAŃSTWOWEGO W EREWEŃSKU nr 2, s.17-25. Patrz Tabela 4.
- ^ Glueckauf, E. (1955). „Wpływ jonów hydratacji na współczynniki aktywności w stężonych roztworach elektrolitów”. Transakcje Towarzystwa Faradaya . 51 : 1235-1244. doi : 10.1039/TF9555101235 .
- ^ Herbert Harned i Benton Owen , Fizyczna chemia roztworów elektrolitycznych , 1950, s. 253.
- ^ Obliczono na podstawie danych w CRC Handbook of Chemistry and Physics, 49. wydanie.
- ^ Kwas cytrynowy Apelblat Alexander (Springer 2014) p.50 ISBN 978-3-319-11233-6
- ^ Harned, Owen, op. cyt. wydanie trzecie 1958, s. 398-399
- ^ Kwas cytrynowy Apelblat p.320
- ^ Apelblat s.320
Zewnętrzne linki
- Pozorne właściwości molowe: rozwiązania: tło
- Właściwości (p,ρ,T) i pozorne objętości molowe etanolowych roztworów LiI lub ZnCl2
- Pozorne objętości molowe i pozorne molowe pojemności cieplne Pr(NO3)3(aq), Gd(NO3)3(aq), Ho(NO3)3(aq) i Y(NO3)3(aq) przy T = (288,15) , 298,15, 313,15 i 328.15) K i p = 0,1 MPa
- Efekty izotopowe dla właściwości pozornych elektrolitów