Arsole - Arsole
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
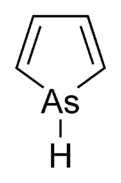
1 H -Arsole |
|||
| Inne nazwy
Arsenole
Arsacyclopentadiene |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChEBI | |||
| ChemSpider | |||
|
PubChem CID
|
|||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 4 H 4 AsH | |||
| Masa cząsteczkowa | 128,00 g mol -1 | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
Pirolu , phosphole , bismole , stibole | ||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Referencje Infobox | |||
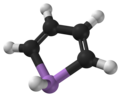
Arsol , zwany także arsenolem lub arsacyklopentadienem , jest związkiem organoarsenowym o wzorze C 4 H 4 AsH. Jest ona klasyfikowana jako metallole i isoelectronic do związane pirolu tym wyjątkiem, że arsen atom jest zastąpiony przez azot atom. Podczas gdy cząsteczka pirolu jest płaska, cząsteczka arsolu nie, a atom wodoru związany z arsenem rozciąga się poza płaszczyznę molekularną. Arsole jest tylko umiarkowanie aromatyczny , z około 40% aromatem pirolu. Sam Arsole nie został opisany w czystej postaci, ale istnieje kilka podstawionych analogów zwanych arsolami . Arsoles bardziej złożonych pochodne arsole mają podobną strukturę i własności chemicznych do tych phosphole pochodne. Kiedy arsol jest połączony z pierścieniem benzenowym , ta cząsteczka nazywana jest arsindolem lub benzarsolem.
Nomenklatura
Arsole należy do serii heterocyklicznych związków pniktogenów . Nazewnictwo cyklicznych związków organoarsenowych, takich jak arsole, opiera się na rozszerzeniu systemu nomenklatury Hantzscha-Widmana zatwierdzonego przez IUPAC , jak podsumowano poniżej:
| Rozmiar pierścionka | Pierścień nienasycony | Pierścień nasycony |
|---|---|---|
| 3 | Arsirene | Arsirane |
| 4 | Arsete | Arsetane |
| 5 | Arsole | Arsolane |
| 6 | Arsinine | Arsinane |
| 7 | Arsepine | Arsepane |
| 8 | Arsocyna | Arsocane |
| 9 | Arsonine | Arsonane |
| 10 | Arsecine | Arsekan |
Ze względu na podobieństwo do angielskiego slangu „ arsehole ” (powszechnie używanego poza Ameryką Północną), nazwa „arsole” została uznana za cel zabawy, „głupie imię” i jeden z kilku związków chemicznych o niezwykłej nazwie . Jednak ten zbieg okoliczności „głupia nazwa” pobudził również szczegółowe badania naukowe.
Nieruchomości
| M | d (MC), Å | d (MH), Ł | α (CMC), ° | E , kJ / mol |
|---|---|---|---|---|
| N | 1.37 | 1.01 | 110 | 0 |
| P. | 1.81 | 1.425 | 90.5 | 67 |
| Tak jak | 1,94 | 1.53 | 86 | 125 |
| Sb | 2.14 | 1.725 | 80.5 | 160 |
| Bi | 2.24 | 1.82 | 78 | 220 |
Sam Arsole nie został jeszcze wyodrębniony eksperymentalnie, ale geometrię molekularną i konfigurację elektronową arsoli zbadano teoretycznie. Obliczenia dotyczyły również właściwości prostych pochodnych arsolu, w których atomy wodoru są zastępowane innymi atomami lub małymi grupami węglowodorowymi, a także istnieją doniesienia doświadczalne dotyczące właściwości chemicznych bardziej złożonych pochodnych arsolu. Sytuacja jest podobna dla innych metaloli C 4 H 4 MH, gdzie M = P, As, Sb i Bi.
Płaskość
Obliczenia wskazują, że podczas gdy pirolu (C 4 H 4 NH) cząsteczka jest płaska, phosphole (C 4 H 4 Ph) i cięższych metalloles nie, i ich azotowce atom wodoru związany wiązaniem wystaje poza płaszczyznę. Podobną tendencję przewiduje się dla fluorowanych pochodnych C 4 F 4 MH (M = N, P, As, ..), ale bariery inwersji są o około 50–100% wyższe. Płaskość jest tracona nawet w pirolu, gdy jego atom wodoru związany z azotem jest podstawiony, np. Atomem fluoru . Jednak płaskość jest oceniana w obliczeniach na podstawie energii wymaganej do konwersji między dwiema konfiguracjami, w których wiązanie MH rozciąga się w lewo lub w prawo od płaszczyzny molekularnej. Jednak niezerowa (mała) wartość tej energii niekoniecznie oznacza, że cząsteczka ma niską symetrię, ze względu na możliwość tunelowania termicznego lub kwantowego między dwiema konfiguracjami.
Aromatyczność
Aromatyczność arsolu przejawia się w delokalizacji i rezonansie jego elektronów pierścieniowych. Jest ściśle powiązany z płaskością, ponieważ im bardziej płaska jest cząsteczka, tym silniejsza jest jej aromatyczność. Aromatyczność arsolu i jego pochodnych jest od lat przedmiotem dyskusji zarówno z eksperymentalnego, jak i teoretycznego punktu widzenia. Przegląd z 2005 roku połączony z obliczeniami chemii kwantowej wykazał, że sam arsol jest „umiarkowanie” aromatyczny, ponieważ jego prąd pierścieniowy wynosi 40% prądu pirolu, o którym wiadomo, że jest aromatyczny. Jednak porównywalny prąd pierścieniowy obliczono dla cyklopentadienu , który od dawna uważany jest za niearomatyczny. Inne raporty sugerują, że aromatyczność (i płaskość) może różnić się między pochodnymi arsolu.
Właściwości chemiczne (pochodne arsolu)
Właściwości chemiczne pochodnych arsolu zbadano eksperymentalnie; są podobne do fosforu i jego pochodnych. Podstawienie wszystkich atomów wodoru w arsolu grupami fenylowymi daje żółte igły krystalicznego pentafenyloarsolu o temperaturze topnienia 215 ° C. Ten kompleks można otrzymać z wydajnością 50–93% w reakcji 1,4-dijodo-1,2,3,4-tetrafenylobutadienu lub 1,4-dilitio-1,2,3,4-tetrafenylobutadienu z fenyloarsenem dichlorek (C 6 H 5 AsCl 2 ) w eterze .
Zastępowanie w tej reakcji trichlorku arsenu w miejsce dichlorku fenylarsenu daje 1-chloro-2,3,4,5-tetrafenyloarsol, który również tworzy żółte igły, ale o niższej temperaturze topnienia 182–184 ° C. Pentafenylarsol można dalej utleniać nadtlenkiem wodoru, w wyniku czego powstają żółte kryształy o temperaturze topnienia 252 ° C. Można go również poddać reakcji z pentakarbonylem żelaza (Fe (CO) 5 ) w izooktanie w temperaturze 150 ° C z wytworzeniem stałego związku organoarsenowego o wzorze C 34 H 25 As, Fe (CO) 3 . Reagujący pentafenyloarsol z metalicznym litem lub potasem daje 1,2,3-trifenylonaftalen .
W wyniku reakcji dichlorku fenyloarsenu z liniowymi difenylami otrzymuje się 1,2,5-trifenyloarsol (patrz poniżej), substancję stałą o temperaturze topnienia około 170 ° C. Ten związek tworzy różne aniony po obróbce metalami alkalicznymi.
Zobacz też
- Pirol , analog azotu .
- Furan , analog tlenu .
- Tiofen , analog siarki .
- Proste aromatyczne pierścienie
- Varsol , destylat ropy naftowej o temperaturze wrzenia 150–200 ° C.