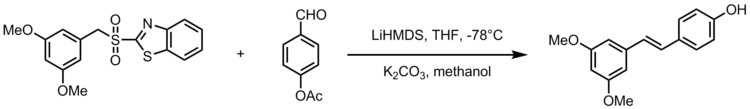Julia olefinujący - Julia olefination
| Julia olefinujący | |
|---|---|
| Nazwany po | marc Julia |
| typ reakcji | Reakcję sprzęgania |
| identyfikatory | |
| Chemia organiczna Portal | Julia-olefinowania |
| RSC ontologia ID | RXNO: 0000117 |
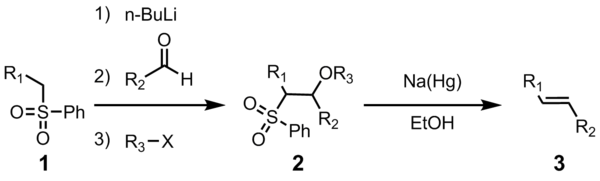
Julia olefinowania (znany również jako Julia-Lythgoe olefinowania) jest reakcja chemiczna stosowane w chemii organicznej do fenylowych sulfonów (1), aldehydy (lub ketonów ) otrzymując Alkeny (olefiny) (3) po funkcjonalizacji alkoholu i redukcyjnej eliminacji z użyciem sodowego amalgamatu lub SMI 2 . Reakcja jest nazwany po francuski chemik Marc Julia .
Użyteczność tej łącznej reakcji olefinowania wynika z jego uniwersalność, z szerokiej grupy funkcyjnej tolerancji i łagodne warunki reakcji, w których reakcja przebiega.
Wszystkie cztery etapy mogą być przeprowadzone w jednym naczyniu reakcyjnym i wykorzystanie R 3 X jest opcjonalne. Jednak oczyszczanie sulfonu pośredniego 2 prowadzi do wyższej wydajności i czystości. Najczęściej R 3 jest acetyl lub benzoil , z bezwodnikiem kwasu octowego lub chlorkiem benzoilu, stosowanych do wytwarzania 2.
Zawartość
Historia
1973, Marc Julia, Jean-Marc Paryż podano nową syntezę olefiny, w którym p-acyloxysulfones zostały wyeliminowane redukcyjnie do odpowiednich di-, tri-, lub tetrasubstitued alkenów. Bazylia Lythgoe i Philip J. Kocienski omówiono możliwość i ograniczenie reakcji, a dziś ten olefinowania formalnie znany jako olefinowanie Julia-Lythgoe. Reakcja obejmuje dodanie sulfonylu stabilizowany karboanionu do związku karbonylowego, a następnie eliminacja z wytworzeniem alkenu. W początkowej wersji reakcji, eliminacji prowadzono w warunkach redukujących. Niedawno, zmodyfikowana wersja, że unika ten krok został opracowany. Dawna wersja jest czasami określany jako olefinowania Julia-Lythgoe, podczas gdy ten ostatni jest nazywany olefinujący Julia-Kocienski. W wariancie redukcyjnego addukt zwykle acylować i następnie traktuje się środkiem redukującym, takim jak amalgamat sodowy lub SMI 2 . Kilka opinii tych reakcji zostały opublikowane.
mechanizm reakcji
Pierwsze kroki są proste. Fenyl sulfon anion (2) reaguje z aldehydem z wytworzeniem alkoksydu (3). Alkoholan funkcjonalizuje R 3 -X, z wytworzeniem trwałego produktu pośredniego (4). Dokładny mechanizm redukcji amalgamat sodu jest znana, ale wykazano, przechodzących przez winylowych rodników (5). Protonowanie rodnik winylowy otrzymuje się żądany produkt (6).
Stereochemia alkenu (6), niezależne od stereochemii sulfonu pośredniego 4. Uważa się, że rodnik pośrednie są w stanie równowagi, tak że im bardziej stabilna termodynamicznie trans olefina wytwarzane najczęściej. Transformacja ta jest bardzo sprzyja tworzeniu się E -alkene.
Wariacje
Zmodyfikowany Julia olefinujący
Zmodyfikowany Julia olefinowania, znany również jako jednonaczyniowego Julia olefinowania jest modyfikacją klasycznego Julia olefinowania. Zastąpienie sulfonów fenylowym sulfonów heteroarylowych znacznie zmienia ścieżkę reakcji. Najbardziej popularnym przykładem jest benzotiazolu sulfon. Reakcja benzotiazol sulfonu (1) z diizopropyloamidem litu (LDA) daje metalowanego sulfonu benzotiazolil, który reaguje szybko z aldehydów lub ketonów () z wytworzeniem alkoholan związku pośredniego (2). W przeciwieństwie do sulfonów fenylowych ten alkoholan związku pośredniego (2) jest bardziej reaktywne i ulegają przegrupowaniu Smiles otrzymując sól sulfinian (4). Sól sulfinian (4) spontanicznie wyeliminowania dwutlenku siarki i litu benzothiazolone (5) wytwarzania żądanego alkenu (6).
Ponieważ benzotiazol odmianą olefinowanie Julia nie wymaga nierównowagowych produktów pośrednich, stereochemiczna efekt jest wynikiem stereochemii początkowym dodaniu karbonylową. W wyniku tej reakcji często wytwarza się mieszaninę stereoizomerów alkenowych.
Julia-Kocienski olefinujący
| Julia-Kocienski olefinujący | |
|---|---|
| Nazwany po |
Marc Julia Philip Joseph Kocienski |
| typ reakcji | Reakcję sprzęgania |
| identyfikatory | |
| Chemia organiczna Portal | zmodyfikowanym Julia, Kocienski, olefinowanie |
| RSC ontologia ID | RXNO: 0000304 |
Julia-Kocienski olefinujący, dalsze udoskonalenie zmodyfikowanego Julia olefinowania, oferuje bardzo dobrą E -selectivity. W olefinowania Julia, Kocienski środkiem alkilującym jest tetrazol . Przebiega w tym samym mechanizmie, co benzotiazolu sulfonowej powyżej. Wysoka E -selectivity z olefinowanie Julia, Kocienski jest wynikiem kontrolowanych kinetycznie diastereoselektywnej dodanie metalowanych 1-fenylo-1 H-tetrazol-5-il (PT) sulfonów do niesprzężonych aldehydów. Daje to anty-p-alkoxysulfones stereospecyficznie które rozkładają się do E -alkenów. W jednym, z dostosowaniem t butyltetrazoylmethyl sulfonu warunki reakcji są albo bis (trójmetylosililo) amidek litu w temperaturze -70 ° C w tetrahydrofuranie lub węglan cezu w temperaturze + 70 ° C. Reakcja ta jest nazwana Philip J. Kocienski jego modyfikację olefinowania Julia.
Aplikacje syntetyczne
Jeden lub zmodyfikowanej reakcji olefinowania Julia Julia jest wszechstronny syntetycznej transformacji szeroko wykorzystywane w konstrukcji złożonych produktów naturalnych, z doskonałą kontrolę izomerii geometrycznej.
Pterostilbene
Pterostilbene jest stilbenoid chemicznie związane resweratrol. Należy ona do grupy fitoaleksyny, agentów produkowanych przez rośliny do zwalczania infekcji. Pterostilbene jest naturalnie występującym eter dimetylowy analog resweratrol. Uważa się, że związek ten ma również anty-cukrzycowych właściwości, ale do tej pory niewiele było badane w tej sprawie.
W stosunku do reakcji Wittiga , Wittiga-Hornera, Perkin lub katalizowane metalami przejściowymi reakcjami syntezy pterostilebene, olefinowanie Julia oferuje prostą i ekonomiczną alternatywną metodę przygotowania pterostilbene.
resweratrol
Jeden adaptacja olefinowania Julia-Kocienski daje syntezę stilbenoid resweratrol , naturalny związek znaleźć w typowych żywności, takich jak winogrona, wino i orzechy. Resweratrol jest biologicznie ważne stilbenoid których sugerowano mieć wiele korzyści dla zdrowia. Julia, Kocienski olefinowania służy jako silny reakcji w syntezie analogów resweratrol z 3,5-bis (trifluorometylo) sulfony fenyl. Poniższy schemat przedstawia ogólne schemat syntezy analogów resweratrol, w którym R 2 oznacza grupę arylową.
(-) - kallistatyna
W asymetrycznym całkowitej syntezy (-) - A przez kallistatyna Amos Smith dwa oddzielne olefinations Julia użyto do dołączania dwa E -alkene ugrupowań. (-) - kallistatyna A jest członkiem rodziny leptomycin antybiotyków. Następujące komunikaty schematycznie olefinowania Julia, Kocienski wykorzystywane do osiągnięcia prekursorem produktu naturalnego, jak wskazano za pomocą PT-sulfonu.
Zobacz też
Referencje
- ^ Julia, K .; Paryż, J.-M. Tetrahedron Lett. 1973,14, 4833-4836. (Doi:10,1016 / S0040-4039 (01) 87348-2)
- ^ Kocienski PJ; Lythgoe, B .; Ruston, S. J. Chem. Soc., Perkin Trans. 1 1978, 829.
- ^ Keck GE; Savin, KA; Węglarz, MA , J. Org. Chem. 1995,60, 3194-3204. (Doi:10,1021 / jo00115a041)
- ^ Kocienski PJfosforu i siarki,1985,24, 97-127. (Przejrzeć)
- ^ Kelly, SEComprehensive Organic Synthesis1991,1, 792-806. (Przegląd) (doi:10,1016 / B978-0-08-052349-1.00020-2)
- ^ Blakemore'a PR J. Chem. Soc., Perkin Trans. 1 2002, 2563-2585. (Doi:10,1039 / b208078h)
- ^ Baudin JB; Hareau, G .; Julia, SA; Ruel O. Tetrahedron Lett. 1991,32, 1175. (doi:10,1016 / S0040-4039 (00) 92037-9)
- ^ Truce, WE; Kreider EM; Brand, WW Org. Reagować. 1970,18, 99 (przegląd)
- ^ Paul R. Blakemore, William J. Cole, Philip J. Kocienski Andrew Morley Synlett 1998, 26-28. (Doi:10.1055 / s-1998-1570)
- ^ Christophe Aissy J. Org. Chem. 2006,71, 360-63. (Doi:10,1021 / jo051693a)
- ^ Zając, B. i Kumar, R. (2010). Synteza fluoroolefiny poprzez Julia-Kocienski olefinujący. Syntezę, 2010 (11), 1822/36 (,doi:10.1055 / s-0029-1218789)
- ^ Langcake, P .; Pryce, RJ (1977). „Nowa klasa fitoaleksyny z winorośli”. Experientia33 (2): 151-2. (Doi:10.1007 / BF02124034) PMID 844529.
- ^ Moro AV; Cardoso, FSP; Correia, CRD Heck arylowania styrenów z solami arenediazonium: krótki, efektywny i stereoselektywnej syntezy resweratrol, DMU-212 i analogów. Tetrahedron Lett. 2008, 49 (39), 5668-5671.
- ^ Prabhakar Peddikotla Amar G. Chittiboyina, Ikhlas A. Khan, (2014) ChemInform Streszczenie: Synteza Pterostilbene Julia olefinowania. ChemInform 45,doi:10,1002 / chin.201408101.
- ^ Alonso DA Fuensanta M Nájera C Varea M., J. Org. Chem. 2005; 70: 6404-6416. PMID 16050703.
- ^ AB Smith III i BM Brandt. Całkowita Synteza (-) - kallistatyna A.Org. Łotysz. 2001, 3, 1685/88.
- ^ Robiette R .; Pospíšil J. Na pochodzenia selektywność E / Z w zmodyfikowanej Julia olefinowania: Waga Eliminacja etapu; Eur. J. Org. Chem. 2013, 836-840.