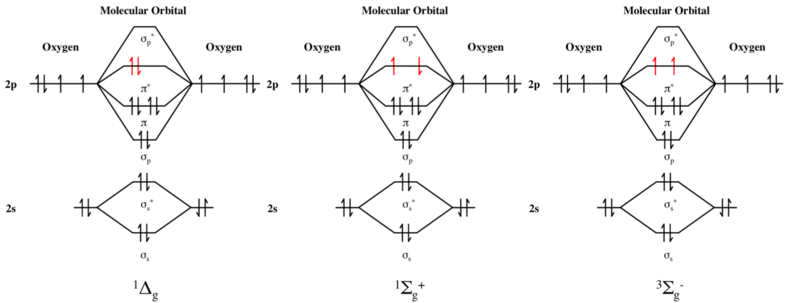Wielość (chemia) - Multiplicity (chemistry)
W spektroskopii i kwantowej chemii The wielość o poziom energii jest zdefiniowane jako 2S + 1 , gdzie S jest całkowita wirowania pędu . Stany o krotności 1, 2, 3, 4, 5 są odpowiednio nazywane singletami , dubletami , trypletami , kwartetami i kwintetami.
W stanie podstawowym atomu lub cząsteczki niesparowane elektrony zwykle mają spin równoległy. W tym przypadku krotność jest również równa liczbie niesparowanych elektronów plus jeden.
Atomy
Wielokrotność jest często równa liczbie możliwych orientacji całkowitego spinu w stosunku do całkowitego orbitalnego momentu pędu L , a zatem liczbie niemal zdegenerowanych poziomów, które różnią się jedynie energią interakcji spin-orbita .
Na przykład, stan podstawowy węgla atomem to 3 stan P. Indeks górny trzy (czytany jako triplet ) wskazuje, że krotność 2S+1 = 3, tak że całkowity spin S = 1. Ten spin wynika z dwóch niesparowanych elektronów , w wyniku reguły Hunda, która faworyzuje pojedyncze wypełnienie zdegenerowanych orbitali . Trójka składa się z trzech stanów o składowych spinowych +1, 0 i –1 wzdłuż kierunku całkowitego orbitalnego momentu pędu, który jest również 1, jak wskazuje litera P. Całkowita liczba kwantowa momentu pędu J może różnić się od L+S = 2 do L–S = 0 w krokach całkowitych, tak że J = 2, 1 lub 0.
Jednak krotność jest równa liczbie orientacji spinu tylko wtedy, gdy S ≤ L. Gdy S > L, możliwe są tylko 2L+1 orientacji całkowitego momentu pędu, w zakresie od S+L do SL. Stan podstawowy atomu azotu to stan 4 S, dla którego 2S + 1 = 4 w stanie kwartetu , S = 3/2 dzięki trzem niesparowanym elektronom. Dla stanu S, L = 0, więc J może wynosić tylko 3/2 i jest tylko jeden poziom, mimo że krotność wynosi 4.
Cząsteczki
Większość stabilnych cząsteczek organicznych ma kompletne powłoki elektronowe bez niesparowanych elektronów, a zatem mają singletowe stany podstawowe. Dotyczy to również molekuł nieorganicznych zawierających tylko pierwiastki z grupy głównej . Ważnymi wyjątkami są dwutlen (O 2 ) oraz metylen (CH 2 ) i inne karbeny .
Jednakże wyższe stany wirowania mielone są bardzo częste w koordynacyjne kompleksy z metalami przejściowymi . Proste wyjaśnienie stanów spinowych takich kompleksów dostarcza teoria pola krystalicznego .
Ditlen
Najwyższym zajętym poziomem energii orbitalnej tlenu jest para orbitali antywiążących π* . W podstawowym stanie ditlenu ten poziom energii zajmują dwa elektrony o tym samym spinie, jak pokazano na molekularnym schemacie orbitalnym . Cząsteczka ma zatem dwa niesparowane elektrony i jest w stanie trypletowym.
W przeciwieństwie do tego, pierwszy i drugi stan wzbudzony ditlenu są obydwoma stanami tlenu singletowego . Każdy ma dwa elektrony o przeciwnym spinie na poziomie π* tak, że S = 0 i w konsekwencji krotność wynosi 2S + 1 = 1.
W pierwszym stanie wzbudzonym dwa elektrony π* są sparowane na tym samym orbicie, tak że nie ma niesparowanych elektronów. Natomiast w drugim stanie wzbudzonym dwa elektrony π* zajmują różne orbitale o przeciwnym spinie. Każdy jest zatem niesparowanym elektronem, ale całkowity spin wynosi zero, a krotność wynosi 2S + 1 = 1 pomimo dwóch niesparowanych elektronów. Wielokrotność drugiego stanu wzbudzonego nie jest więc równa liczbie jego niesparowanych elektronów plus jeden, a reguła, która zwykle obowiązuje dla stanów podstawowych, jest nieważna dla tego stanu wzbudzonego.
Karbeny
W chemii organicznej , karbenów są cząsteczki mające atomach węgla tylko sześć elektronów walencyjnych i tym samym łamią się reguła oktetu . Karbeny generalnie dzielą się na karbeny singletowe i karbeny tripletowe , nazwane ze względu na ich krotność spinów. Oba mają dwa niewiążące elektrony; w karbenach singletowych istnieją one jako pojedyncza para i mają przeciwne spiny, tak że nie ma spinu netto, podczas gdy w karbenach tripletowych elektrony te mają spiny równoległe.
Zobacz też
Bibliografia
Bibliografia
- Atkinsa, Piotra; de Paula, Julio (2006). Chemia fizyczna Atkinsa (8th ed.). Stany Zjednoczone: Oxford University Press . Numer ISBN 0-7167-8759-8.
- Clayden, Jonathan; Greeves, Nick; Warrena, Stuarta; Wothers, Piotr (2001). Chemia organiczna . Stany Zjednoczone: Oxford University Press . Numer ISBN 0-19-850346-6.
- Levine, Ira N. (1991). Chemia kwantowa (wyd. 4). Stany Zjednoczone: Prentice-Hall . Numer ISBN 0-205-12770-3.
- Miessler, Gary L.; Tarr, Donald A. (1999). Chemia nieorganiczna (wyd. 2). Prentice-Hall. Numer ISBN 0-13-841891-8.