Spektroskopia magnetycznego rezonansu jądrowego węglowodanów - Nuclear magnetic resonance spectroscopy of carbohydrates
Spektroskopia węglowodanowego NMR polega na zastosowaniu spektroskopii magnetycznego rezonansu jądrowego (NMR) do analizy strukturalnej i konformacyjnej węglowodanów . Metoda ta pozwala naukowcom na wyjaśnienie struktury monosacharydów , oligosacharydów , polisacharydów , glikokoniugatów i innych pochodnych węglowodanów ze źródeł syntetycznych i naturalnych. Wśród właściwości strukturalnych, które można określić za pomocą NMR, są: struktura pierwszorzędowa (w tym stereochemia), konformacja sacharydów, stechiometria podstawników i stosunek poszczególnych sacharydów w mieszaninie. Nowoczesne instrumenty NMR o wysokim polu, stosowane do próbek węglowodanów, zwykle 500 MHz lub więcej, są w stanie przeprowadzić zestaw eksperymentów 1D, 2D i 3D w celu określenia struktury związków węglowodanowych.
Obserwowalne NMR węglowodanów
Przesunięcie chemiczne
Typowe zakresy przesunięć chemicznych dla jąder w obrębie reszt węglowodanowych to:
- Typowe przesunięcia chemiczne 1 H NMR protonów pierścienia węglowodanowego wynoszą 3–6 ppm (4,5–5,5 ppm dla protonów anomerycznych).
- Typowe przesunięcia chemiczne 13 C NMR atomów węgla w pierścieniach węglowodanowych wynoszą 60–110 ppm
W przypadku prostych cząsteczek mono- i oligosacharydów, wszystkie sygnały protonów są zwykle oddzielane od siebie (zwykle przy częstotliwości 500 MHz lub lepszych instrumentach NMR) i można je przypisać tylko przy użyciu widma 1D NMR. Jednak większe cząsteczki wykazują znaczne nakładanie się sygnałów protonowych, zwłaszcza w obszarze nieanomerycznym (3-4 ppm). NMR węgla-13 przezwycięża tę wadę dzięki większemu zakresowi przesunięć chemicznych i specjalnym technikom pozwalającym na blokowanie sprzężenia spinowego węgla z protonem, dzięki czemu wszystkie sygnały węgla na wysokich i wąskich singletach można odróżnić od siebie.
Typowe zakresy przesunięć chemicznych specyficznych węglowodanów węgla w niepodstawionych monosacharydach to:
- Węgle anomeryczne: 90-100 ppm
- Węgle z pierścieni cukrowych posiadające funkcję hydroksylową: 68-77
- Węgle cukrowe w formie otwartej z funkcją hydroksylową: 71-75
- Węgle z pierścieni cukrowych z funkcją aminową: 50-56
- Egzocykliczne grupy hydroksymetylowe: 60–64
- Egzocykliczne grupy karboksylowe: 172-176
- Odtlenione węgle z pierścieni cukrowych: 31-40
- Węgiel przy zamknięciu pierścienia piranozowego: 71-73 (α-anomery), 74-76 (β-anomery)
- Węgiel na zamknięciu pierścienia furanozy: 80-83 (α-anomery), 83-86 (β-anomery)
Stałe sprzężenia
Bezpośrednie stałe sprzęgania węgiel-proton są wykorzystywane do badania anomerycznej konfiguracji cukru. Wicynalne stałe sprzęgania proton-proton są wykorzystywane do badania orientacji stereo protonów względem innych protonów w pierścieniu cukrowym, identyfikując w ten sposób monosacharyd. Wicynalne heterojądrowe stałe sprzęgania HCOC są wykorzystywane do badania kątów skręcania wzdłuż wiązania glikozydowego między cukrami lub wzdłuż fragmentów egzocyklicznych, ujawniając w ten sposób konformację molekularną.
Pierścienie cukrowe są stosunkowo sztywnymi fragmentami molekularnymi, stąd charakterystyczne są wicynalne sprzężenia proton-proton:
- Równikowo do osi: 1–4 Hz
- Równikowe do równikowego: 0–2 Hz
- Osiowe do osiowego, nieanomeryczne: 9–11 Hz
- Osiowe do osiowego anomeryczne: 7–9 Hz
- Osiowy do egzocyklicznego hydroksymetylu: 5 Hz, 2 Hz
- Geminal między protonami hydroksymetylowymi: 12 Hz
Efekty jądrowego Overhausera (NOE)
NOE są wrażliwe na odległości międzyatomowe, co pozwala na ich użycie jako sondy konformacyjnej lub dowodu na tworzenie się wiązania glikozydowego. Powszechną praktyką jest porównywanie obliczonych wartości NOE z eksperymentalnymi protonowo-protonowymi NOE w oligosacharydach w celu potwierdzenia teoretycznej mapy konformacyjnej. Obliczenie NOE implikuje optymalizację geometrii molekularnej.
Inne obserwowalne NMR
Relaksacje, szybkości relaksacji jądra, kształt linii i inne parametry były przydatne w badaniach strukturalnych węglowodanów.
Wyjaśnienie struktury węglowodanów metodą spektroskopii NMR
Parametry strukturalne węglowodanów
Poniżej znajduje się lista cech strukturalnych, które można wyjaśnić za pomocą NMR:
- Struktura chemiczna każdej reszty węglowodanowej w cząsteczce, w tym
- rozmiar szkieletu węglowego i rodzaj cukru (aldoza / ketoza)
- wielkość cyklu (piranoza / furanoza / liniowa)
- konfiguracja stereo wszystkich węgli (identyfikacja monosacharydów)
- stereo konfiguracja anomerycznego węgla (α / β)
- konfiguracja absolutna (D / L)
- lokalizacja funkcji amino-, karboksy-, dezoksy- i innych
- Struktura chemiczna reszt niewęglowodanowych w cząsteczce (aminokwasy, kwasy tłuszczowe, alkohole, organiczne aglikony itp.)
- Podstawienia pozycji w resztach
- Sekwencja pozostałości
- Stechiometria reszt końcowych i łańcuchów bocznych
- Lokalizacja wiązań diestrowych fosforanowych i siarczanowych
- Stopień polimeryzacji i pozycjonowanie ramki (dla polisacharydów)
Spektroskopia NMR a inne metody
Powszechnie znane metody badań strukturalnych, takie jak spektrometria mas i analiza rentgenowska, mają jedynie ograniczone zastosowanie do węglowodanów. Takie badania strukturalne, takie jak określanie sekwencji lub identyfikacja nowych monosacharydów, przynoszą największe korzyści ze spektroskopii NMR. Absolutną konfigurację i stopień polimeryzacji nie zawsze można określić za pomocą samego NMR, więc proces wyjaśniania struktury może wymagać dodatkowych metod. Chociaż skład monomeryczny można rozwiązać za pomocą NMR, metody chromatograficzne i spektroskopii masowej czasami dostarczają tych informacji łatwiej. Inne cechy strukturalne wymienione powyżej można określić wyłącznie metodami spektroskopowymi NMR. Ograniczeniem badań strukturalnych NMR węglowodanów jest to, że wyjaśnienie struktury nie może być zautomatyzowane i wymaga od eksperta-człowieka wyprowadzenia struktury z widm NMR.
Zastosowanie różnych technik NMR do węglowodanów
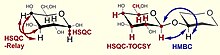
Złożone glikany posiadają wiele nakładających się sygnałów, zwłaszcza w widmie protonowym. Dlatego korzystne jest wykorzystanie eksperymentów 2D do przypisywania sygnałów. Poniższa tabela i rysunki przedstawiają najbardziej rozpowszechnione techniki NMR stosowane w badaniach węglowodanów.
| Eksperyment NMR | Opis | Uzyskane informacje |
|---|---|---|
| 1 H 1D | Widmo protonów 1D | pomiar sprzężeń, informacje ogólne, identyfikacja pozostałości, podstawa przypisania widma węglowego |
| 13 C BB | Widmo 1D węgla-13 z odsprzężeniem protonu | szczegółowe informacje, identyfikacja pozostałości, pozycje substytucyjne |
| 31 P BB, 15 N BB | Widma 1D heterojądrowych odsprzęgniętych protonów | Dodatkowe informacje |
| APT, 13 C DEPT | dołączony test protonowy, napędzany wzmocniony transfer polaryzacyjny (edytowane widmo 1D węgiel-13) | Przypisanie CH 2 grupami |
| 13 C Z bramą, 31 P Z bramą | Widma 1D węgla-13 i heterojądra sprzężonego z protonem | pomiary sprzężeń heterojądrowych, wyjaśnienie konfiguracji anomerycznej, badania konformacyjne |
| 1 H, 1 H J -rozdzielone | Wykres 2D NMR przedstawiający sprzężenia typu J w drugim wymiarze | dokładne sprzężenia J i wartości przesunięcia chemicznego dla zatłoczonych obszarów widmowych |
| 1 H DOSY | Wykres 2D NMR z widmami protonów w funkcji współczynnika dyfuzji molekularnej | pomiar współczynnika dyfuzji, oszacowanie wielkości / masy cząsteczkowej, separacja widmowa różnych cząsteczek w mieszaninie |
| 1 H, 1 H COSY | Korelacja spinów protonów | przypisanie widma protonów za pomocą sprzężeń wicynalnych |
| PRZYTULNY RCT, PRZYTULNY RCT2 | Korelacja spinów protonów z jedno- lub dwustopniowym przekazywanym transferem koherencji | przypisanie widma protonowego, w którym sygnały sąsiednich sąsiadujących protonów nakładają się |
| DQF COSY | Podwójnie filtrowana kwantowo korelacja spinów protonów | Wielkość sprzężenia J i liczba protonów uczestniczących w sprzężeniu J. |
| 1 H HD róż | Selektywne sprzęganie różnicowe | analiza kształtu linii nakładających się sygnałów protonów |
| TOCSY (HOHAHA) | Całkowita korelacja wszystkich protonów w układzie spinowym | rozróżnianie układów spinowych pozostałości |
| 1D TOCSY | TOCSY pojedynczego sygnału | ekstrakcja układu spinowego pewnej pozostałości |
| NIE TAK, ROESY | Korelacja efektu Homonuclear Nuclear Overhausera (w przestrzeni) | ujawnienie przestrzennie proksymalnych par protonów, określenie sekwencji reszt, wyznaczenie uśrednionej konformacji |
| 1 H NOE dif | Selektywny pomiar różnicowy NOE | badania kontaktów przestrzennych protonów |
| 1 H, 13 C HSQC | Heteronuklearna koherencja pojedynczego kwantu, bezpośrednia korelacja spinów proton-węgiel | przypisanie widma węgla |
| 1 H, 31 P. HSQC | Heteronuklearna koherencja kwantowa, korelacja spinów protonów i fosforu | lokalizacja reszt kwasu fosforowego w fosfoglikanach |
| 1 H, 13 C HMBC | Wielojądrowa korelacja wiązań wielojądrowych, wicynalna korelacja spinów proton-węgiel | określenie sekwencji reszt, wzór acetylacji / amidacji, potwierdzenie pozycji podstawienia |
| 1 H, X 1D HMBC | HMBC dla pojedynczego sygnału | przypisanie protonu wokół określonego węgla lub heteroatomu |
| 1 H, 13 C Przekaźnik HSQC | Ukryta korelacja węgiel-węgiel poprzez wicynalne sprzężenia przyłączonych protonów | przypisanie sąsiednich atomów węgla |
| 1 H, 13 C HSQC-TOCSY | Korelacja protonów ze wszystkimi atomami węgla w układzie spinowym i odwrotnie | przypisanie C5 za pomocą H6 i rozwiązywanie podobnych problemów, rozdział widma węgla na podzakresy reszt |
| 1 H, X 1D NOE | Heterojądrowy pomiar NOE | heterojądrowe kontakty przestrzenne, konformacje |
Schemat badawczy
Badania spektroskopowe NMR obejmują następujące kroki:
- Ekstrakcja surowca węglowodanowego (dla naturalnych glikanów)
- Chemiczne usuwanie ugrupowań maskujących prawidłowość (dla polimerów)
- Oddzielanie i oczyszczanie materiału węglowodanowego (w przypadku eksperymentów 2D NMR zalecane jest 10 mg lub więcej)
- Przygotowanie próbki (zwykle w D2O)
- Akwizycja widm 1D
- Planowanie, akwizycja i przetwarzanie innych eksperymentów NMR (zwykle zajmuje od 5 do 20 godzin)
- Przypisywanie i interpretacja widm (patrz przykładowy rysunek)
- Jeśli problemu strukturalnego nie można rozwiązać: chemiczna modyfikacja / degradacja i analiza NMR produktów
- Pozyskiwanie widm związku natywnego (niezamaskowanego) i ich interpretacja na podstawie zmodyfikowanej struktury
- Prezentacja wyników
Bazy danych i narzędzia węglowodanowego NMR
Utworzono wiele baz danych dotyczących przesunięć chemicznych i powiązanych usług, aby pomóc w strukturalnym wyjaśnieniu i analizie eksperckiej ich widm NMR. Spośród nich kilka narzędzi informatycznych jest poświęconych wyłącznie węglowodanom:
- GlycoSCIENCES.de
- ponad 2000 widm NMR glikanów ssaków
- poszukiwanie struktury na podstawie sygnałów NMR i odwrotnie
-
CSDB (baza danych struktur węglowodanów) zawiera:
- ponad 4000 widm NMR glikanów bakteryjnych, roślinnych i grzybowych,
- poszukiwanie struktury na podstawie sygnałów NMR i odwrotnie
- procedura symulacji widm empirycznych zoptymalizowana pod kątem węglowodanów,
- statystyczne oszacowanie przesunięcia chemicznego w oparciu o algorytm HOSE zoptymalizowany pod kątem węglowodanów,
- narzędzie do generowania struktur i rankingu oparte na NMR.
- CASPER (wspomagana komputerowo ocena widma regularnych polisacharydów). zawiera:
- baza danych dotyczących zmian chemicznych,
- procedura symulacji widm empirycznych zoptymalizowana pod kątem węglowodanów,
- interfejs online.
- narzędzie dopasowujące strukturę. Aby uzyskać dostęp do informacji o strukturze, można wykorzystać przesunięcia chemiczne protonu i węgla C i H.
Symulacja obserwacji NMR

Dokonano przeglądu kilku podejść do symulacji obserwowalnych NMR węglowodanów. Zawierają:
- Podejścia do uniwersalnych baz danych statystycznych (ACDLabs, Modgraph itp.)
- Wykorzystanie sieci neuronowych do uściślenia prognoz
- Metody oparte na regresji
- OPŁATA
- Schematy empiryczne zoptymalizowane pod kątem węglowodanów (CSDB / BIOPSEL, CASPER).
- Połączone obliczenia mechaniki molekularnej / dynamiki geometrii i kwantowo-mechaniczna symulacja / iteracja obserwacji NMR (oprogramowanie PERCH NMR)
- Podejścia ONIOM (optymalizacja różnych części cząsteczki z różną dokładnością)
- Obliczenia Ab initio .
Rosnąca moc obliczeniowa pozwala na wykorzystanie dokładnych obliczeń kwantowo-mechanicznych na wysokich poziomach teoretycznych i dużych bazach do udoskonalenia geometrii molekularnej węglowodanów i późniejszego przewidywania obserwacji NMR przy użyciu GIAO i innych metod z uwzględnieniem efektu rozpuszczalnika lub bez niego. Wśród kombinacji poziomu teoretycznego i zbioru podstaw, które zostały uznane za wystarczające do przewidywania NMR, były B3LYP / 6-311G ++ (2d, 2p) i PBE / PBE (patrz przegląd). W przypadku sacharydów wykazano, że schematy empiryczne zoptymalizowane pod kątem węglowodanów zapewniają znacznie lepszą dokładność (0,0-0,5 ppm na rezonans 13 C) niż metody chemii kwantowej (powyżej 2,0 ppm na rezonans) uznane za najlepsze dla symulacji NMR i działają tysiące razy szybciej. Jednak metody te mogą przewidywać tylko przesunięcia chemiczne i mają słabe wyniki w przypadku niewęglowodanowych części cząsteczek. Jako reprezentatywny przykład, patrz rysunek po prawej stronie.
Zobacz też
- Metody spektroskopii 1D i 2D NMR w badaniach strukturalnych naturalnych glikopolimerów (wykład)
- Bazy węglowodanów w ostatnim dziesięcioleciu (wykład; obejmuje dane symulacyjne NMR)
- Węglowodan
- Glycan
- Magnetyczny rezonans jądrowy
- Spektroskopia magnetycznego rezonansu jądrowego kwasów nukleinowych
- Spektroskopia jądrowego rezonansu magnetycznego białek
- Spektroskopia NMR
- Nuklearny efekt Overhausera
Bibliografia
Dalsza lektura
- D. Łowicki; A. Czarny; J. Młynarski (2013). Jądrowy rezonans magnetyczny: NMR węglowodanów . Królewskie Towarzystwo Chemii . p. 383. ISBN 978-1-84973-577-3 .
Linki zewnętrzne
-
 Media związane ze spektroskopią jądrowego rezonansu magnetycznego węglowodanów w Wikimedia Commons
Media związane ze spektroskopią jądrowego rezonansu magnetycznego węglowodanów w Wikimedia Commons