Potencjalna powierzchnia energii - Potential energy surface
Powierzchni energii potencjalnej ( PES ) przedstawia energię układu, w szczególności zbiór atomów, w zakresie określonych parametrów, zazwyczaj położeń atomów. Powierzchnia może definiować energię jako funkcję jednej lub więcej współrzędnych; jeśli istnieje tylko jedna współrzędna, powierzchnia nazywana jest krzywą energii potencjalnej lub profilem energii . Przykładem jest potencjał Morse'a / dalekiego zasięgu .
Warto posłużyć się analogią krajobrazu: dla układu o dwóch stopniach swobody (np. Dwóch długościach wiązań) wartość energii (analogia: wysokość terenu) jest funkcją dwóch długości wiązań (analogia: współrzędne pozycji na ziemi).
Koncepcja PES znajduje zastosowanie w takich dziedzinach, jak chemia i fizyka, zwłaszcza w teoretycznych działach tych przedmiotów. Można go wykorzystać do teoretycznego zbadania właściwości struktur złożonych z atomów, na przykład do znalezienia kształtu cząsteczki o minimalnej energii lub obliczenia szybkości reakcji chemicznej.
Definicja matematyczna i obliczenia
Geometrię zbioru atomów można opisać za pomocą wektora r , którego elementy reprezentują pozycje atomów. Wektor r może być zbiorem kartezjańskich współrzędnych atomów lub może być również zbiorem odległości i kątów między atomami.
Biorąc pod uwagę r , energia jako funkcja pozycji, E ( r ) , jest wartością E ( r ) dla wszystkich r będących przedmiotem zainteresowania. Posługując się analogią krajobrazu ze wstępu, E podaje wysokość „krajobrazu energetycznego”, tak aby powstała koncepcja potencjalnej powierzchni energetycznej .
Aby zbadać reakcję chemiczną przy użyciu PES jako funkcji pozycji atomów, konieczne jest obliczenie energii dla każdego interesującego układu atomów. Metody obliczania energii określonego rozmieszczenia atomów w atomach są dobrze opisane w artykule chemii obliczeniowej , a nacisk zostanie położony na znalezienie przybliżeń E ( r ), aby uzyskać drobnoziarnistą informację o położeniu energii.
W przypadku bardzo prostych układów chemicznych lub gdy dokonuje się uproszczonych przybliżeń dotyczących oddziaływań międzyatomowych, czasami można użyć wyrażenia wyprowadzonego analitycznie na energię jako funkcję pozycji atomów. Przykładem jest potencjał London - Eyring - Polanyi -Sato dla systemu H + H 2 jako funkcja trzech odległości HH.
W przypadku bardziej skomplikowanych systemów obliczenie energii określonego układu atomów jest często zbyt kosztowne obliczeniowo, aby odwzorowanie powierzchni w dużej skali było wykonalne. W przypadku tych systemów możliwym podejściem jest obliczenie tylko zredukowanego zestawu punktów w PES, a następnie użycie tańszej obliczeniowo metody interpolacji, na przykład interpolacji Sheparda , w celu wypełnienia luk.
Podanie
PES to koncepcyjne narzędzie wspomagające analizę geometrii molekularnej i dynamiki reakcji chemicznych . Po oszacowaniu niezbędnych punktów na PES, punkty można sklasyfikować zgodnie z pierwszą i drugą pochodną energii w odniesieniu do położenia, którymi są odpowiednio gradient i krzywizna . Punkty stacjonarne (lub punkty o zerowym gradiencie) mają znaczenie fizyczne: minima energii odpowiadają fizycznie stabilnym gatunkom chemicznym, a punkty siodłowe odpowiadają stanom przejściowym , najwyższemu punktowi energii na współrzędnej reakcji (który jest najniższym szlakiem energii łączącym reagent chemiczny z produkt chemiczny).
Atrakcyjne i odpychające powierzchnie
Potencjalne powierzchnie energetyczne dla reakcji chemicznych można sklasyfikować jako atrakcyjne lub odpychające , porównując wydłużenia długości wiązań w aktywowanym kompleksie w stosunku do reagentów i produktów. Dla reakcji typu A + B — C → A — B + C wydłużenie długości wiązania dla nowo utworzonego wiązania A — B jest zdefiniowane jako R * AB = R AB - R 0 AB , gdzie R AB jest A— Długość wiązania B w stanie przejściowym i R 0 AB w cząsteczce produktu. Podobnie dla wiązania, które jest zrywane w reakcji, R * BC = R BC - R 0 BC , gdzie R 0 BC odnosi się do cząsteczki reagenta.
W przypadku reakcji egzotermicznych PES jest klasyfikowany jako atrakcyjny (lub wczesny spadek ), jeśli R * AB > R * BC , tak że stan przejściowy jest osiągany, gdy reagenty zbliżają się do siebie. Po przejściu w stan przejściowy, długość wiązania A – B nadal się zmniejsza, tak że duża część uwolnionej energii reakcji jest przekształcana w energię wibracyjną wiązania A – B. Przykładem jest reakcja harpunowa K + Br 2 → K — Br + Br, w której początkowe, dalekosiężne przyciąganie reagentów prowadzi do aktywowanego kompleksu przypominającego K + • •• Br - ••• Br. Wzbudzone wibracyjnie populacje cząsteczek produktu można wykryć za pomocą chemiluminescencji w podczerwieni .
W przeciwieństwie do tego PES dla reakcji H + Cl 2 → HCl + Cl jest odpychający (lub późny zjazd ), ponieważ R * HCl <R * ClCl i stan przejściowy jest osiągany, gdy produkty się rozdzielają. W tej reakcji, w której atom A (tutaj H) jest lżejszy niż B i C, energia reakcji jest uwalniana głównie jako translacyjna energia kinetyczna produktów. W przypadku reakcji takiej jak F + H 2 → HF + H, w której atom A jest cięższy niż B i C, następuje uwolnienie energii mieszanej , zarówno wibracyjnej, jak i translacyjnej, mimo że PES jest odpychający.
W przypadku reakcji endotermicznych rodzaj powierzchni określa rodzaj energii, która jest najbardziej efektywna w wywoływaniu reakcji. Energia translacyjna reagentów jest najbardziej efektywna w wywoływaniu reakcji z atrakcyjną powierzchnią, podczas gdy wzbudzenie wibracyjne (do wyższej wibracyjnej liczby kwantowej v) jest bardziej skuteczne w reakcjach z odpychającą powierzchnią. Jako przykład tego ostatniego przypadku, reakcja F + HCl (v = 1) → Cl + HF jest około pięć razy szybsza niż F + HCl (v = 0) → Cl + HF przy tej samej całkowitej energii HCl.
Historia
Koncepcję powierzchni energii potencjalnej dla reakcji chemicznych po raz pierwszy zaproponował francuski fizyk René Marcelin w 1913 r. Pierwsze półempiryczne obliczenia powierzchni energii potencjalnej zostały zaproponowane dla reakcji H + H 2 przez Henry'ego Eyringa i Michaela Polanyi w 1931 r. Eyring użył powierzchni energii potencjalnej do obliczenia stałych szybkości reakcji w teorii stanu przejściowego w 1935 roku.
H + H 2 dwuwymiarowy PES
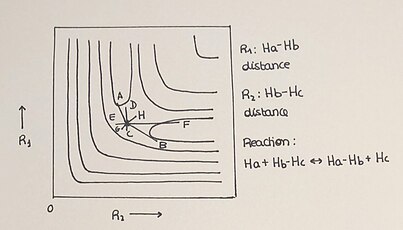
Powierzchnie energii potencjalnej są zwykle przedstawiane jako trójwymiarowe wykresy, ale można je również przedstawić za pomocą dwuwymiarowych wykresów, na których postęp reakcji jest wykreślany za pomocą linii izoenergetycznych. Układ współliniowy H + H 2 to prosta reakcja, która pozwala na wykreślenie dwuwymiarowego PES w łatwy i zrozumiały sposób. W tej reakcji atom wodoru (H) reaguje z cząsteczką diwodoru (H 2 ), tworząc nowe wiązanie z jednym atomem cząsteczki, co z kolei przerywa wiązanie pierwotnej cząsteczki. Jest to symbolizowane jako H a + H b –H c → H a –H b + H c . Przebieg reakcji od reagentów (H + H₂) do produktów (HHH), jak również energia gatunków biorących udział w reakcji, są dobrze określone na odpowiedniej powierzchni energii potencjalnej. Profile energii opisują energię potencjalną jako funkcję zmiennych geometrycznych (PES w dowolnym wymiarze są niezależne od czasu i temperatury).
Mamy różne istotne elementy w 2-D PES:
- Wykres 2-D pokazuje punkty minimalne, w których znajdujemy reagenty , produkty i punkt siodełka lub stan przejściowy .
- Stan przejściowy to maksimum we współrzędnej reakcji i minimum we współrzędnej prostopadłej do ścieżki reakcji.
- Upływ czasu opisuje trajektorię każdej reakcji. W zależności od warunków reakcji, proces pokaże różne drogi dojścia do tworzenia produktu naniesionego między dwiema osiami.
Zobacz też
- Chemia obliczeniowa
- Minimalizacja energii (lub optymalizacja geometrii)
- Profil energetyczny (chemia)
- Współrzędna reakcji