Potencjał spoczynkowy - Resting potential
Względnie statyczny potencjał membrany, który jest zwykle określany jako wartość masy dla napięcia transbłonowego.
/ K +
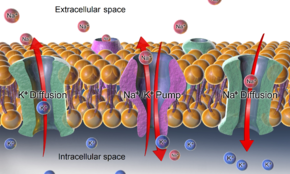
-ATPaza , jak również efekty dyfuzji zaangażowanych jonów, są głównymi mechanizmami utrzymywania potencjału spoczynkowego przez błony komórek zwierzęcych.
Względnie statyczny potencjał błonowy komórek znajdujących się w stanie spoczynku nazywany jest spoczynkowym potencjałem błony (lub napięciem spoczynkowym), w przeciwieństwie do specyficznych dynamicznych zjawisk elektrochemicznych zwanych potencjałem czynnościowym i stopniowanym potencjałem błony .
Oprócz dwóch ostatnich, które występują w komórkach pobudliwych ( neuronach , mięśniach i niektórych komórkach wydzielniczych w gruczołach ), napięcie błonowe większości komórek niepobudliwych może również ulegać zmianom w odpowiedzi na bodźce środowiskowe lub wewnątrzkomórkowe. Potencjału spoczynkowego występuje ze względu na różnice w przepuszczalności błony dla potasu , sodu , wapnia i chlorkowych jonów , które z kolei są wynikiem aktywności funkcjonalnej różnych kanałów jonowych , transporterów jonowych i wymienników. Konwencjonalnie, spoczynkowy potencjał błony można zdefiniować jako stosunkowo stabilną, podstawową wartość napięcia transbłonowego w komórkach zwierzęcych i roślinnych.
Typowy potencjał spoczynkowy błony komórkowej wynika z oddzielenia jonów potasu od wewnątrzkomórkowych, względnie nieruchomych anionów przez błonę komórki. Ponieważ przepuszczalność błony dla potasu jest znacznie wyższa niż dla innych jonów, a także z powodu silnego gradientu chemicznego dla potasu, jony potasu przepływają z cytozolu do przestrzeni zewnątrzkomórkowej z ładunkiem dodatnim, aż ich ruch zostanie zrównoważony przez nagromadzenie się ładunek ujemny na wewnętrznej powierzchni membrany. Ponownie, ze względu na wysoką względną przepuszczalność potasu, uzyskany potencjał błonowy jest prawie zawsze zbliżony do potencjału odwrócenia potasu . Aby jednak ten proces zaszedł, należy najpierw ustawić gradient stężeń jonów potasu. Ta praca jest wykonywana przez pompy / transportery jonów i / lub wymienniki i generalnie jest zasilana przez ATP .
W przypadku potencjału błony spoczynkowej przez błonę plazmatyczną komórki zwierzęcej , gradienty potasu (i sodu) są ustalane przez Na + / K + -ATPase (pompa sodowo-potasowa), która transportuje 2 jony potasu do wewnątrz i 3 jony sodu na zewnątrz w koszt 1 cząsteczki ATP. W innych przypadkach, na przykład, potencjał błonowy można ustalić przez zakwaszenie wnętrza przedziału błoniastego (takiego jak pompa protonowa, która generuje potencjał błonowy przez błony pęcherzyka synaptycznego ).
Electroneutrality
W większości ilościowych analiz potencjału błonowego, takich jak wyprowadzanie równania Goldmana , zakłada się elektroobojętność ; to znaczy, że nie ma mierzalnego nadmiaru ładunku po żadnej stronie membrany. Tak więc, chociaż istnieje potencjał elektryczny w poprzek membrany z powodu rozdzielenia ładunku, nie ma rzeczywistej mierzalnej różnicy w globalnym stężeniu jonów dodatnich i ujemnych na membranie (jak oszacowano poniżej ), to znaczy nie ma rzeczywistej mierzalnej naładuj nadmiar po obu stronach. Dzieje się tak, ponieważ wpływ ładunku na potencjał elektrochemiczny jest znacznie większy niż efekt koncentracji, więc niewykrywalna zmiana stężenia powoduje wielką zmianę potencjału elektrycznego.
Generowanie potencjału spoczynkowego
Błony komórkowe są zazwyczaj przepuszczalne tylko dla podzbioru jonów. Zwykle są to jony potasu, jony chlorkowe, jony wodorowęglanowe i inne. Aby uprościć opis podstawy jonowej potencjału spoczynkowego błony, najbardziej przydatne jest rozważenie na początku tylko jednego gatunku jonowego, a pozostałe rozważenie później. Ponieważ potencjały transbłonowe są prawie zawsze określane przede wszystkim przez przepuszczalność potasu, od tego należy zacząć.
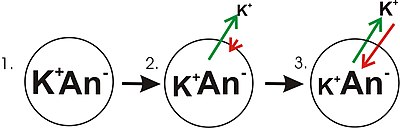
- Panel 1 diagramu przedstawia schematycznie prostą komórkę, w której gradient stężenia został już ustalony. Ten panel jest rysowany tak, jakby membrana nie przepuszczała żadnego jonu. Nie ma potencjału błonowego, ponieważ pomimo istnienia gradientu stężenia potasu, nie ma nierównowagi ładunku netto w poprzek membrany. Gdyby membrana miała stać się przepuszczalna dla typu jonów, które są bardziej skoncentrowane po jednej stronie membrany, wówczas ten jon przyczyniłby się do napięcia membrany, ponieważ jony przepuszczające przemieszczałyby się przez membranę z ruchem netto tego typu jonów w dół stężenia gradient. Wystąpiłby ruch netto od strony membrany o wyższym stężeniu jonu na stronę o niższym stężeniu. Taki ruch jednego jonu przez błonę spowodowałby nierównowagę ładunku w błonie i potencjału błonowego. Jest to powszechny mechanizm, dzięki któremu wiele komórek tworzy potencjał błonowy.
- W panelu 2 diagramu błona komórkowa została przepuszczalna dla jonów potasu, ale nie dla anionów (An - ) wewnątrz komórki. Głównym źródłem tych anionów jest białko. W gradiencie stężenia jonów potasowych zmagazynowana jest energia, którą można przekształcić w gradient elektryczny, gdy jony potasu (K + ) opuszczają komórkę. Zauważ, że jony potasu mogą przemieszczać się przez błonę w obu kierunkach, ale w wyniku czysto statystycznego procesu, który wynika z wyższego stężenia jonów potasu w komórce, więcej jonów potasu będzie wychodzić z komórki. Ponieważ w komórkach występuje większe stężenie jonów potasu, w ich przypadkowym ruchu molekularnym istnieje większe prawdopodobieństwo napotkania poru przepuszczalności ( kanału jonowego ), co ma miejsce w przypadku jonów potasu znajdujących się na zewnątrz i przy niższym stężeniu. Wewnętrzne K + jest po prostu „bardziej prawdopodobne”, że opuści komórkę niż zewnątrzkomórkowe K + ma do niej wejść. Jest to kwestia dyfuzji, która polega na rozpraszaniu gradientu stężeń. Gdy potas opuszcza komórkę, pozostawia aniony. Dlatego separacja ładunku rozwija się, gdy K + opuszcza komórkę. Ta separacja ładunków wytwarza napięcie transmembranowe. To napięcie transmembranowe jest potencjałem błony. Ponieważ potas nadal opuszcza komórkę, oddzielając kolejne ładunki, potencjał błony będzie nadal wzrastał. Długość strzałek (zielona wskazująca gradient stężenia, czerwona wskazująca napięcie) reprezentuje wielkość ruchu jonów potasu w wyniku każdej formy energii. Kierunek strzałki wskazuje kierunek, w którym działa ta konkretna siła. Zatem napięcie membrany budynku jest rosnącą siłą, która działa przeciwstawnie do tendencji do ruchu netto jonów potasu w dół gradientu stężenia potasu.
- Na panelu 3 napięcie membrany wzrosło do tego stopnia, że jego „siła” odpowiada teraz gradientom stężenia. Ponieważ te siły (które są przyłożone do K + ) mają teraz taką samą siłę i są skierowane w przeciwnych kierunkach, system jest teraz w równowadze . Innymi słowy, tendencja potasu do opuszczania komórki przez spływanie w dół jej gradientu stężenia jest teraz dopasowana do tendencji napięcia błony do przyciągania jonów potasu z powrotem do komórki. K + nadal przemieszcza się przez błonę, ale szybkość, z jaką wchodzi i wychodzi z komórki jest taka sama, a zatem nie ma prądu potasowego netto . Ponieważ K + jest w równowadze, potencjał błony jest stabilny lub „spoczywa” (E K ).
Napięcie spoczynkowe jest wynikiem kilku enzymów przemieszczających jony ( uniporterów , kotransporterów i pomp ) w błonie plazmatycznej, stabilnie działających równolegle, dzięki czemu każdy translokator jonów ma swoją charakterystyczną siłę elektromotoryczną (= potencjał odwrócenia = `` napięcie równowagi '') , w zależności od poszczególnych stężeń substratu wewnątrz i na zewnątrz (wewnętrzne ATP włączone w przypadku niektórych pomp). ATPaza eksportująca H + sprawia, że napięcie błony roślin i grzybów jest znacznie bardziej ujemne niż w bardziej szczegółowo badanych komórkach zwierzęcych, gdzie napięcie spoczynkowe jest określane głównie przez selektywne kanały jonowe.
W większości neuronów potencjał spoczynkowy ma wartość około -70 mV. Potencjał spoczynkowy zależy głównie od stężenia jonów w płynach po obu stronach błony komórkowej i białek transportujących jony znajdujących się w błonie komórkowej. W jaki sposób stężenia jonów i białek transportujących błonę wpływają na wartość potencjału spoczynkowego przedstawiono poniżej.
Potencjał spoczynkowy komórki można najdokładniej zrozumieć, myśląc o nim w kategoriach potencjałów równowagi. Na przedstawionym tu diagramie przykładowym komórce modelowej podano tylko jeden przepuszczalny jon (potas). W tym przypadku potencjał spoczynkowy tej komórki byłby taki sam jak potencjał równowagi dla potasu.
Jednak prawdziwa komórka jest bardziej skomplikowana, ma przepuszczalność wielu jonów, z których każdy przyczynia się do potencjału spoczynkowego. Aby lepiej zrozumieć, rozważ komórkę zawierającą tylko dwa przenikające jony, potas i sód. Rozważmy przypadek, w którym te dwa jony mają równe gradienty stężeń skierowane w przeciwnych kierunkach, a przepuszczalność membrany dla obu jonów jest równa. K + pozostawiając komórki będą miały tendencję do przeciągania potencjału błonowego w kierunku E K . Na + wchodzący do komórki będzie miał tendencję do przeciągania potencjału błony w kierunku potencjału odwrócenia E Na sodu . Ponieważ przepuszczalności dla obu jony ustawiona jako równa potencjał membrana na koniec Na + / K + holownika wojennych, kończy się w połowie drogi pomiędzy E sodowym i E K . Ponieważ E Na i E K były równe, ale miały przeciwne znaki, w połowie między nimi jest zero, co oznacza, że membrana spoczywa przy 0 mV.
Należy zauważyć, że chociaż potencjał błonowy przy 0 mV jest stabilny, nie jest to stan równowagi, ponieważ żaden z jonów uczestniczących nie jest w równowadze. Jony dyfundują w dół swoich gradientów elektrochemicznych przez kanały jonowe, ale potencjał błony jest podtrzymywany przez ciągły dopływ K + i wypływ Na + przez transportery jonów . Taka sytuacja z podobnymi przepuszczalnościami dla przeciwdziałających jonów, takich jak potas i sód w komórkach zwierzęcych, może być niezwykle kosztowna dla komórki, jeśli te przepuszczalności są stosunkowo duże, ponieważ pompowanie jonów z powrotem wymaga dużej ilości energii ATP . Ponieważ żadna rzeczywista komórka nie może sobie pozwolić na tak równą i dużą przepuszczalność jonów w spoczynku, potencjał spoczynkowy komórek zwierzęcych jest określany przez przeważającą wysoką przepuszczalność dla potasu i dostosowywany do wymaganej wartości przez modulowanie przepuszczalności i gradientów sodu i chlorków.
W zdrowej komórce zwierzęcej przepuszczalność Na + wynosi około 5% przepuszczalności K + lub nawet mniej, podczas gdy odpowiednie potencjały odwrócenia wynoszą +60 mV dla sodu ( E Na ) i -80 mV dla potasu ( E K ). Zatem potencjał błonowy nie będzie dokładnie w E K , ale raczej zdepolaryzowany z E K w ilości około 5% z 140 mV różnicy między E K i E Na . Zatem potencjał spoczynkowy komórki będzie wynosił około -73 mV.
W bardziej formalnym zapisie potencjał błonowy jest średnią ważoną potencjału równowagi każdego jonu składowego. Wielkość każdego odważnika to względne przewodnictwo każdego jonu. W normalnym przypadku, gdy trzy jony przyczyniają się do potencjału błony:
- ,
gdzie
- E m to potencjał błony mierzony w woltach
- E X jest potencjałem równowagi jonu X, również w woltach
- g X / g tot to względne przewodnictwo jonu X, które jest bezwymiarowe
- g tot to całkowite przewodnictwo wszystkich przenikających jonów w dowolnych jednostkach (np. siemens dla przewodnictwa elektrycznego), w tym przypadku g K + + g Na + + g Cl -
Białka transportujące przez błonę
Przy określaniu potencjałów błonowych dwa najważniejsze typy błonowych białek transportujących jony to kanały jonowe i transportery jonów . Białka kanału jonowego tworzą ścieżki przez błony komórkowe, przez które jony mogą biernie dyfundować bez bezpośredniego wydatkowania energii metabolicznej. Mają selektywność względem określonych jonów, dlatego istnieją kanały jonowe selektywne względem potasu , chlorków i sodu . Różne komórki, a nawet różne części jednej komórki ( dendryty , ciała komórkowe , węzły Ranviera ) będą miały różne ilości różnych białek transportujących jony. Zazwyczaj ilość niektórych kanałów potasowych jest najważniejsza dla kontroli potencjału spoczynkowego (patrz poniżej). Niektóre pompy jonowe, takie jak Na + / K + -ATPaza, są elektrogenne, to znaczy powodują nierównowagę ładunku w błonie komórkowej i mogą również bezpośrednio przyczyniać się do potencjału błony. Większość pomp do działania wykorzystuje energię metaboliczną (ATP).
Potencjały równowagi
Dla większości komórek zwierzęcych jony potasu (K + ) są najważniejsze dla potencjału spoczynkowego. Dzięki aktywnemu transportowi jonów potasu stężenie potasu w komórkach jest wyższe niż na zewnątrz. Większość komórek ma białka kanału jonowego selektywne względem potasu, które pozostają otwarte przez cały czas. Nastąpi ruch netto dodatnio naładowanych jonów potasu przez te kanały potasowe, co spowoduje nagromadzenie się nadmiernego ładunku ujemnego wewnątrz komórki. Ruch dodatnio naładowanych jonów potasu na zewnątrz jest spowodowany przypadkowym ruchem molekularnym ( dyfuzją ) i trwa do momentu, gdy wewnątrz komórki zgromadzi się wystarczający nadmiar ładunku ujemnego, aby utworzyć potencjał błonowy, który może zrównoważyć różnicę w stężeniu potasu między wnętrzem i na zewnątrz komórki. „Równowaga” oznacza, że siła elektryczna ( potencjał ), która wynika z gromadzenia się ładunku jonowego i która utrudnia dyfuzję na zewnątrz, rośnie, aż osiągnie wielkość równą, ale przeciwną do tendencji do dyfuzyjnego ruchu potasu na zewnątrz. Ten punkt równowagi jest potencjałem równowagi, ponieważ strumień transbłonowy netto (lub prąd ) K + wynosi zero. Dobre przybliżenie potencjału równowagi danego jonu wymaga tylko stężeń po obu stronach membrany i temperatury. Można to obliczyć za pomocą równania Nernsta :
gdzie
- E eq, K + jest potencjałem równowagi potasu, mierzonym w woltach
- R jest uniwersalną stałą gazową , równą 8,314 dżuli · K −1 · mol −1
- T to temperatura bezwzględna mierzona w kelwinach (= K = stopnie Celsjusza + 273,15)
- z jest liczbą elementarnych ładunków danego jonu biorących udział w reakcji
- F jest stała Faraday'a , równy 96,485 kulombów · mola -1 ORj · V -1 · mola -1
- [K + ] o to pozakomórkowe stężenie potasu, mierzone w mol · m −3 lub mmol · l −1
- [K + ] i jest również wewnątrzkomórkowym stężeniem potasu
Potencjały równowagi potasu około -80 miliwoltów (wewnątrz ujemne) są powszechne. Różnice obserwuje się u różnych gatunków, w różnych tkankach tego samego zwierzęcia i tych samych tkankach w różnych warunkach środowiskowych. Stosując powyższe równanie Nernsta, można uwzględnić te różnice poprzez zmiany względnego stężenia K + lub różnice temperatur.
W powszechnym użyciu równanie Nernsta jest często podawane w uproszczonej formie, zakładając typową temperaturę ciała ludzkiego (37 ° C), redukując stałe i przełączając się na log o podstawie 10. (Jednostki używane do określenia stężenia są nieważne, ponieważ zrównają się z stosunek). Dla potasu w normalnej temperaturze ciała można obliczyć potencjał równowagi w miliwoltach jako:
Podobnie potencjał równowagi dla sodu (Na + ) w normalnej temperaturze ludzkiego ciała jest obliczany przy użyciu tej samej uproszczonej stałej. Możesz obliczyć E zakładając zewnętrzne stężenie [K + ] o 10 mM i wewnętrzne stężenie [K + ] i 100 mM. Dla jonów chlorkowych (Cl - ) znak stałej musi być odwrócony (-61,54 mV). Przy obliczaniu potencjału równowagi dla wapnia (Ca 2+ ) ładunek 2+ zmniejsza o połowę uproszczoną stałą do 30,77 mV. Przy pracy w temperaturze pokojowej, około 21 ° C, obliczone stałe wynoszą około 58 mV dla K + i Na + , -58 mV dla Cl - i 29 mV dla Ca 2+ . W temperaturze fizjologicznej, około 29,5 ° C i stężeniach fizjologicznych (które są różne dla każdego jonu), obliczone potencjały wynoszą około 67 mV dla Na + , -90 mV dla K + , -86 mV dla Cl - i 123 mV dla Ca 2 + .
Odpoczynkowe potencjały
Spoczynkowy potencjał błony nie jest potencjałem równowagi, ponieważ opiera się na stałym wydatkowaniu energii (dla pomp jonowych, jak wspomniano powyżej) do jego utrzymania. Jest to potencjał dynamicznej dyfuzji, który bierze pod uwagę ten mechanizm - zupełnie odmienny od potencjału równowagi, który jest prawdziwy bez względu na charakter rozważanego systemu. Spoczynkowy potencjał błony jest zdominowany przez formy jonowe w systemie, które mają największe przewodnictwo w poprzek błony. W przypadku większości komórek jest to potas. Ponieważ potas jest również jonem o najbardziej ujemnym potencjale równowagi, zwykle potencjał spoczynkowy nie może być bardziej ujemny niż potencjał równowagi potasu. Potencjał spoczynkowy można obliczyć za pomocą równania napięciowego Goldmana-Hodgkina-Katza, wykorzystując stężenia jonów jak dla potencjału równowagi, uwzględniając jednocześnie względne przepuszczalności każdego rodzaju jonowego. W normalnych warunkach można bezpiecznie założyć, że tylko jony potasu, sodu (Na + ) i chlorku (Cl - ) odgrywają dużą rolę w potencjale spoczynkowym:
To równanie przypomina równanie Nernsta, ale ma termin dla każdego przenikającego jonu. Ponadto, z została włożona do równania, powodując wewnątrzkomórkowe i zewnątrzkomórkowe stężenie Cl - być odwrócona w stosunku do K + i Na + , jako ładunek dodatni chlorkowych jest obsługiwane przez odwrócenie część wewnątrz terminu logarytmicznej. * E m jest potencjałem błony mierzonym w woltach * R , T i F są jak powyżej * P s jest względną przepuszczalnością jonu s * [s] Y jest stężeniem jonu sw przedziale Y jak powyżej. Innym sposobem spojrzenia na potencjał błony, biorąc pod uwagę raczej przewodnictwo kanałów jonowych niż przepuszczalność membrany, jest użycie równania Millmana (zwanego również równaniem przewodnictwa akordów):
lub przeformułowany
gdzie g tot jest połączonym przewodnictwem wszystkich rodzajów jonowych, ponownie w jednostkach arbitralnych. To ostatnie równanie przedstawia spoczynkowy potencjał błony jako średnią ważoną odwróconych potencjałów układu, gdzie wagi to względne przewodnictwa każdego jonu ( g X / g tot ). Podczas potencjału czynnościowego wagi te zmieniają się. Jeśli przewodności Na + i Cl - są równe zero, potencjał membrany zmniejsza się do potencjału Nernsta dla K + (jako g K + = g tot ). Normalnie, w warunkach spoczywa g Na + i g Cl nie jest zerowy, ale są one o wiele mniejsze niż g K + , co sprawia, e m blisko E równoważnika, K + . Stany medyczne, takie jak hiperkaliemia, w której zmienia się poziom potasu w surowicy krwi (który reguluje [K + ] o ), są bardzo niebezpieczne, ponieważ równoważą E eq, K + , wpływając w ten sposób na E m . Może to powodować arytmie i zatrzymanie akcji serca . Zastosowanie szybkiego wstrzyknięcia chlorku potasu w wykonywaniu śmiertelnych wstrzyknięć zatrzymuje serce poprzez przesunięcie potencjału spoczynkowego do wartości bardziej dodatniej, co powoduje depolaryzację i trwałe obkurczenie komórek serca, uniemożliwiając sercu repolaryzację, a tym samym ponowne napełnienie rozkurczu krwią.
Chociaż równanie napięcia GHK i równanie Millmana są powiązane, nie są równoważne. Krytyczna różnica polega na tym, że równanie Millmana zakłada, że zależność prąd-napięcie jest omowa, podczas gdy równanie napięciowe GHK bierze pod uwagę małe, chwilowe rektyfikacje przewidywane przez równanie strumienia GHK, spowodowane gradientem stężeń jonów. W związku z tym dokładniejsze oszacowanie potencjału błony można obliczyć za pomocą równania GHK niż za pomocą równania Millmana.
Pomiar potencjałów spoczynkowych
W niektórych komórkach potencjał błonowy zawsze się zmienia (np. Komórki rozrusznika serca ). Dla takich komórek nigdy nie ma „odpoczynku”, a „potencjał spoczynkowy” jest pojęciem teoretycznym. Inne komórki z niewielkimi funkcjami transportu błonowego, które zmieniają się w czasie, mają spoczynkowy potencjał błony, który można zmierzyć, wkładając elektrodę do komórki. Potencjały transbłonowe można również mierzyć optycznie za pomocą barwników, które zmieniają swoje właściwości optyczne zgodnie z potencjałem błony.
Podsumowanie wartości potencjału spoczynkowego w różnych typach komórek
| Typy komórek | Potencjał spoczynkowy |
|---|---|
| Komórki mięśni szkieletowych | -95 mV |
| Astroglia | Od -80 do -90 mV |
| Neurony | Od -60 do -70 mV |
| Komórki mięśni gładkich | -60 mV |
| Aorta Tkanka mięśni gładkich | -45mV |
| Komórki fotoreceptorowe | -40 mV |
| Komórka włosa ( ślimak ) | Od -15 do -40 mV |
| Erytrocyty | -8,4 mV |
| Chondrocyty | -8mV |
Historia
Prądy spoczynkowe w nerwach zostały zmierzone i opisane przez Juliusa Bernsteina w 1902 roku, gdzie zaproponował "Teorię błony", która wyjaśniała potencjał spoczynkowy nerwów i mięśni jako potencjał dyfuzyjny.
Zobacz też
Bibliografia
Zewnętrzne linki
- Neuroscience - podręcznik online autorstwa Purvesa i wsp.
- Basic Neurochemistry Molecular, Cellular, and Medical Aspects, Siegel, et al.
- Bertil Hille Ion Channels of excitable membranes , 3rd ed., Sinauer Associates, Sunderland, MA (2001). ISBN 0-87893-321-2 .Linki zewnętrzne
- Wright, SH (2004). „Generowanie spoczynkowego potencjału błony” . Adv Physiol Educ . 28 (1–4): 139–42. doi : 10.1152 / advan.00029.2004 . PMID 15545342 . S2CID 5009629 .
- Spoczynkowy potencjał błony - notatki z wykładów online na temat spoczynkowego potencjału błony
- Pochodzenie potencjału spoczynkowej błony - interaktywny samouczek online


![E_ {eq, K ^ +} = \ frac {RT} {zF} \ ln \ frac {[K ^ +] _ {o}} {[K ^ +] _ {i}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)
![E _ {{eq, K ^ {+}}} = 61,54mV \ log {\ frac {[K ^ {+}] _ {{o}}} {[K ^ {+}] _ {{i}}} },](https://wikimedia.org/api/rest_v1/media/math/render/svg/9d0b62ffda044574b1a52306113028c6a29c89f2)
![E _ {{m}} = {\ frac {RT} {F}} \ ln {\ left ({\ frac {P _ {{Na ^ {+}}} [Na ^ {+}] _ {{o}} + P _ {{K ^ {+}}} [K ^ {+}] _ {{o}} + P _ {{Cl ^ {-}}} [Cl ^ {-}] _ {{i}}} { P _ {{Na ^ {+}}} [Na ^ {+}] _ {{i}} + P _ {{K ^ {+}}} [K ^ {+}] _ {{i}} + P_ { {Cl ^ {-}}} [Cl ^ {-}] _ {{o}}}} \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/aef443116c02ee0a29c6f4d6f5a5fc571e530ec8)

