Nonachlorek trirenu - Trirhenium nonachloride

|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Chlorek renu (III)
|
|
| Inne nazwy
Trichlorek renu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA |
100.033.610 |
| Numer WE | |
|
PubChem CID
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| ReCl 3 | |
| Masa cząsteczkowa | 292,57 g / mol |
| Wygląd | czerwone, krystaliczne, nielotne ciało stałe |
| Gęstość | 4800 kg / m 3 |
| Temperatura topnienia | Nie dotyczy |
| Temperatura wrzenia | 500 ° C (932 ° F, 773 K) (rozkłada się) |
| hydrolizuje tworząc Re 2 O 3 . x H 2 O. | |
| Struktura | |
| Romboedryczny , hR72 | |
| R-3m, nr 166 | |
| ( trimeryczne ciało stałe iw roztworze) ( dimeryczne w kwasie octowym) |
|
| Zagrożenia | |
| Główne zagrożenia | Żrący ( C ) |
| Arkusz danych dotyczących bezpieczeństwa | Zewnętrzna karta charakterystyki |
| Związki pokrewne | |
|
Inne aniony
|
Trójbromek renu Trójjodek renu |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencje Infobox | |
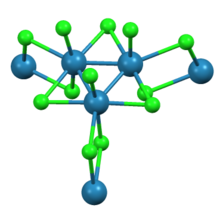
Nonachlorek trirenu jest związkiem o wzorze ReCl 3 , czasami również zapisywanym jako Re 3 Cl 9 . Jest to ciemnoczerwone higroskopijne ciało stałe nierozpuszczalne w zwykłych rozpuszczalnikach. Związek ten jest ważny w historii chemii nieorganicznej jako wczesny przykład związku klastrowego z wiązaniami metal-metal. Jest używany jako materiał wyjściowy do syntezy innych kompleksów renu.
Struktura i właściwości fizyczne
Jak wykazała krystalografia rentgenowska, nonachlorek trirenu składa się z podjednostek Re 3 Cl 12, które dzielą trzy mostki chlorkowe z sąsiednimi klastrami. Połączona sieć klastrów tworzy arkusze. Wokół każdego centrum Re znajduje się siedem ligandów, cztery chlorki mostkujące, jeden końcowy chlorek i dwa wiązania Re-Re.
Ciepła utleniania ocenia się według następującego równania:
- 1/3 Re 3 Cl 9 + 4 OH - + 2 OCl - → ReO 4 - + 2 H 2 O + 5Cl -
Entalpia tego procesu wynosi 190,7 ± 0,2 kcal / mol.
Przygotowanie i reakcje
Związek został odkryty w 1932 roku, chociaż pracownicy ci nie określili jego struktury, co jest nietypowe dla chlorków metali. Nonachlorek trihenu jest skutecznie przygotowywany przez termiczny rozkład pięciochlorku renu lub kwasu heksachlorofenowego (IV):
- 3 ReCl 5 → Re 3 Cl 9 + 3 Cl 2
Jeśli próbka jest sublimowana próżniowo w temperaturze 500 ° C, uzyskany materiał jest stosunkowo niereaktywny, ale częściowo uwodniony materiał może być bardziej przydatny syntetycznie. Inne metody syntetyczne, obejmują traktowanie renu z chlorkiem sulfurylu . Ten proces jest czasami prowadzony z dodatkiem chlorku glinu . Uzyskuje się go również przez ogrzewanie Re 2 (O 2 CCH 3 ) 4 Cl 2 pod HCl:
- 3/2 Re 2 (O 2 CCH 3 ) 4 Cl 2 + 6 HCl → Re 3 Cl 9 + 6 HO 2 CCH 3
Reakcja tri- i pentachlorków daje czterochlorek renu :
- 3 ReCl 5 + Re 3 Cl 9 → 6 ReCl 4