Rura T - T-tubule
| rurka T | |
|---|---|
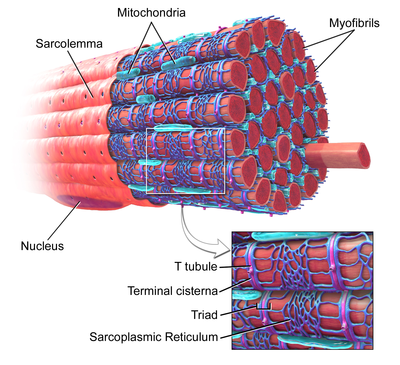
Włókno mięśni szkieletowych , z oznaczonym rurką T w powiększonym obrazie.
| |
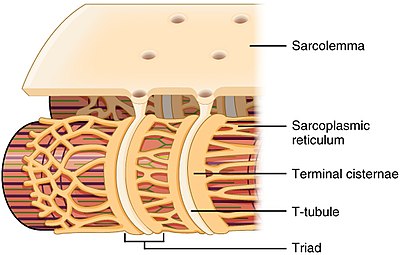 Budowa kanalika T i związek z siateczką sarkoplazmatyczną w mięśniu szkieletowym
| |
| Detale | |
| Część | Błona komórkowa z szkieletowych i komórek mięśnia sercowego . |
| Identyfikatory | |
| łacina | kanalika poprzecznego |
| TH | H2.00.05.2.01018, H2.05.2.02013 |
| Terminologia anatomiczna | |
Kanaliki T ( kanaliki poprzeczne ) są przedłużeniami błony komórkowej , które przenikają do środka komórek mięśni szkieletowych i sercowych . Dzięki błonom, które zawierają duże stężenia kanałów jonowych , transporterów i pomp, kanaliki T umożliwiają szybką transmisję potencjału czynnościowego do komórki, a także odgrywają ważną rolę w regulacji stężenia wapnia w komórce.
Dzięki tym mechanizmom kanaliki T pozwalają komórkom mięśnia sercowego na silniejsze kurczenie się poprzez synchronizację uwalniania wapnia w całej komórce. Na strukturę i funkcję kanalików T wpływa z każdym uderzeniem skurcz kardiomiocytów, a także choroby, potencjalnie przyczyniające się do niewydolności serca i arytmii . Chociaż te struktury zostały po raz pierwszy zaobserwowane w 1897 roku, trwają badania nad biologią kanalików T.
Struktura
Kanaliki T są kanalikami utworzonymi z tej samej dwuwarstwy fosfolipidowej co błona powierzchniowa lub sarkolemma komórek mięśni szkieletowych lub sercowych. Łączą się bezpośrednio z sarkolemmą na jednym końcu, zanim podróżują w głąb komórki, tworząc sieć kanalików z odcinkami biegnącymi zarówno prostopadle (poprzecznie), jak i równolegle (osiowo) do sarkolemmy. Ze względu na tę złożoną orientację niektórzy określają rurki T jako poprzeczno-osiowy układ rurowy. Wnętrze lub światło kanalika T jest otwarte na powierzchni komórki, co oznacza, że kanalik T jest wypełniony płynem zawierającym te same składniki, co roztwór otaczający komórkę (płyn pozakomórkowy). Membrana, która tworzy kanaliki T, nie jest tylko pasywną rurką łączącą, jest bardzo aktywna i zawiera białka, w tym kanały wapniowe typu L , wymienniki sodowo-wapniowe , ATPazy wapniowe i beta-adrenergiczne .
Kanaliki T znajdują się zarówno w przedsionkowych, jak i komorowych komórkach mięśnia sercowego ( kardiomiocyty ), w których rozwijają się w pierwszych tygodniach życia. Znajdują się one w komórkach mięśnia komorowego większości gatunków oraz w komórkach mięśnia przedsionkowego dużych ssaków. W komórkach mięśnia sercowego, u różnych gatunków, kanaliki T mają średnicę od 20 do 450 nanometrów i są zwykle zlokalizowane w obszarach zwanych dyskami Z, gdzie miofilamenty aktynowe zakotwiczają się w komórce. Kanaliki T w sercu są ściśle związane z wewnątrzkomórkowym magazynem wapnia znanym jako retikulum sarkoplazmatyczne w określonych regionach, zwanych cysternami końcowymi. Połączenie rurki T ze zbiornikiem końcowym jest znane jako diada .
W komórkach mięśni szkieletowych kanaliki T są trzy do czterech razy węższe niż w komórkach mięśnia sercowego i mają średnicę od 20 do 40 nm. Zazwyczaj są one zlokalizowane po obu stronach paska miozyny, na połączeniu nakładania się (złącze AI) między pasmami A i I. Kanaliki T w mięśniu szkieletowym są związane z dwiema końcowymi cysternami, znanymi jako triada .
Regulatory
Kształt systemu kanalików T jest wytwarzany i utrzymywany przez różne białka. Białko amfifizyna-2 jest kodowane przez gen BIN1 i odpowiada za tworzenie struktury kanalika T oraz zapewnienie umiejscowienia odpowiednich białek (w szczególności kanałów wapniowych typu L) w obrębie błony kanalika T. Junctophilin-2 jest kodowana przez gen JPH2 i pomaga w tworzeniu połączenia między błoną kanalika T a retikulum sarkoplazmatycznym, niezbędne do sprzężenia między pobudzeniem a skurczem . Titin zatykania białka znanego jako telethonin jest kodowany przez gen TCAP i pomaga w rozwoju T kanalików i jest potencjalnie odpowiedzialny za wzrost liczby limfocytów T kanalików postrzegane jako mięśnie wzrasta.
Funkcjonować
Sprzęgło wzbudzenie-skurcz
Rurki T są ważnym ogniwem w łańcuchu od pobudzenia elektrycznego komórki do jej późniejszego skurczu (sprzężenie pobudzenie-skurcz). Gdy potrzebny jest skurcz mięśnia, stymulacja z nerwu lub sąsiedniej komórki mięśniowej powoduje charakterystyczny przepływ naładowanych cząstek przez błonę komórkową, znany jako potencjał czynnościowy . W spoczynku po wewnętrznej stronie membrany znajduje się mniej dodatnio naładowanych cząstek w porównaniu do strony zewnętrznej, a membrana jest opisywana jako spolaryzowana. Podczas potencjału czynnościowego dodatnio naładowane cząstki (głównie jony sodu i wapnia) przepływają przez membranę z zewnątrz do wewnątrz. To odwraca normalną nierównowagę naładowanych cząstek i jest określane jako depolaryzacja . Jeden obszar błony depolaryzuje sąsiednie regiony, a powstała fala depolaryzacji rozprzestrzenia się następnie wzdłuż błony komórkowej. Polaryzacja błony zostaje przywrócona, gdy jony potasu przepływają z powrotem przez błonę od wewnątrz na zewnątrz komórki.
W komórkach mięśnia sercowego, gdy potencjał czynnościowy przechodzi przez kanaliki T, aktywuje on kanały wapniowe typu L w błonie kanalików T. Aktywacja kanału wapniowego typu L umożliwia przechodzenie wapnia do komórki. Kanaliki T zawierają wyższe stężenie kanałów wapniowych typu L niż reszta sarkolemy, a zatem większość wapnia, który dostaje się do komórki, występuje przez kanaliki T. Ten wapń wiąże się i aktywuje receptor, znany jako receptor rianodynowy , zlokalizowany w wewnętrznym magazynie wapnia komórki, siateczce sarkoplazmatycznej. Aktywacja receptora rianodyny powoduje uwolnienie wapnia z retikulum sarkoplazmatycznego, powodując kurczenie się komórki mięśniowej. Jednak w komórkach mięśni szkieletowych kanał wapniowy typu L jest bezpośrednio przyłączony do receptora rianodyny na siateczce sarkoplazmatycznej, umożliwiając bezpośrednią aktywację receptora rianodyny bez konieczności dopływu wapnia.
Znaczenie kanalików T wynika nie tylko z ich koncentracji kanałów wapniowych typu L, ale również z ich zdolności do synchronizowania uwalniania wapnia w komórce. Szybkie rozprzestrzenianie się potencjału czynnościowego wzdłuż sieci kanalików T aktywuje prawie jednocześnie wszystkie kanały wapniowe typu L. Ponieważ kanaliki T zbliżają sarkolemmę bardzo blisko retikulum sarkoplazmatycznego we wszystkich regionach komórki, wapń może być następnie uwalniany z retikulum sarkoplazmatycznego przez całą komórkę w tym samym czasie. Ta synchronizacja uwalniania wapnia pozwala komórkom mięśniowym na mocniejsze kurczenie się. W komórkach pozbawionych kanalików T, takich jak komórki mięśni gładkich , chore kardiomiocyty lub komórki mięśniowe, w których kanaliki T zostały sztucznie usunięte, wapń, który dostaje się do sarkolemy, musi stopniowo dyfundować po całej komórce, aktywując receptory ryanodyny znacznie wolniej jako fala wapnia prowadząca do mniej silnego skurczu.
Ponieważ kanaliki T są głównym miejscem sprzęgania wzbudzenia i skurczu, kanały jonowe i białka zaangażowane w ten proces są tutaj skoncentrowane - w błonie kanalika T znajduje się 3 razy więcej kanałów wapniowych typu L w porównaniu z resztą sarkolemy. Ponadto beta adrenoceptory są również silnie skoncentrowane w błonie kanalików T, a ich stymulacja zwiększa uwalnianie wapnia z retikulum sarkoplazmatycznego.
Kontrola wapnia
Ponieważ przestrzeń w świetle kanalika T jest ciągła z przestrzenią otaczającą komórkę (przestrzeń zewnątrzkomórkowa), stężenia jonów między nimi są bardzo podobne. Jednak ze względu na znaczenie jonów w kanalikach T (szczególnie wapnia w mięśniu sercowym), bardzo ważne jest, aby te stężenia pozostały względnie stałe. Ponieważ kanaliki T są bardzo cienkie, w zasadzie zatrzymują jony. Jest to ważne, ponieważ niezależnie od stężenia jonów w innych częściach komórki, kanaliki T nadal mają wystarczającą ilość jonów wapnia, aby umożliwić skurcz mięśni. Dlatego też, nawet jeśli stężenie wapnia poza komórką spada ( hipokalcemia ), stężenie wapnia w kanaliku T pozostaje względnie stałe, umożliwiając kontynuację skurczu serca.
Oprócz tego, że kanaliki T są miejscem wnikania wapnia do komórki, są również miejscem usuwania wapnia. Jest to ważne, ponieważ oznacza, że poziom wapnia w komórce może być ściśle kontrolowany na małym obszarze (tj. między kanalikiem T a siateczką sarkoplazmatyczną, co jest znane jako kontrola lokalna). Białka, takie jak wymieniacz sodowo-wapniowy i sarkolemalna ATPaza znajdują się głównie w błonie kanalików T. Wymiennik sodowo-wapniowy pasywnie usuwa jeden jon wapnia z komórki w zamian za trzy jony sodu. Jako proces pasywny może zatem umożliwić przepływ wapnia do lub z komórki w zależności od kombinacji względnych stężeń tych jonów i napięcia w błonie komórkowej ( gradient elektrochemiczny ). ATP-aza wapniowa aktywnie usuwa wapń z komórki, wykorzystując energię pochodzącą z trifosforanu adenozyny (ATP).
Detubulacja
W celu zbadania funkcji kanalików T, kanaliki T można sztucznie odłączyć od błony powierzchniowej przy użyciu techniki znanej jako detubulacja . Substancje chemiczne, takie jak glicerol lub formamid (odpowiednio dla mięśni szkieletowych i sercowych) można dodać do roztworu zewnątrzkomórkowego otaczającego komórki. Środki te zwiększają osmolarność roztworu pozakomórkowego, powodując kurczenie się komórek. Kiedy te środki zostaną wycofane, komórki szybko się rozszerzają i wracają do swoich normalnych rozmiarów. To kurczenie się i ponowne rozszerzanie się komórki powoduje, że kanaliki T odrywają się od błony powierzchniowej. Alternatywnie, osmolarność roztworu zewnątrzkomórkowego można zmniejszyć, stosując na przykład hipotoniczną sól fizjologiczną, powodując przejściowy obrzęk komórek. Przywrócenie roztworu zewnątrzkomórkowego do normalnej osmolarności umożliwia komórkom powrót do poprzedniego rozmiaru, ponownie prowadząc do detubulacji.
Historia
Pomysł struktury komórkowej, która później stała się znana jako kanalik T, został po raz pierwszy zaproponowany w 1881 roku. Bardzo krótkie opóźnienie między stymulacją komórki mięśnia poprzecznie prążkowanego a jego późniejszym skurczem było zbyt krótkie, aby mogło być spowodowane przez substancję sygnalizacyjną pokonującą tę odległość między sarkolemmą a siateczką sarkoplazmatyczną. Sugerowano zatem, że woreczki błony docierające do komórki mogą wyjaśniać zaobserwowany bardzo szybki początek skurczu. Dopiero w 1897 roku zaobserwowano pierwsze kanaliki T, używając mikroskopii świetlnej do badania mięśnia sercowego, do którego wstrzyknięto tusz indyjski . Technologia obrazowania rozwinęła się, a wraz z pojawieniem się transmisyjnej mikroskopii elektronowej struktura kanalików T stała się bardziej widoczna, co doprowadziło do opisu podłużnej składowej sieci kanalików T w 1971 roku. W latach 90. i 2000. mikroskopia konfokalna umożliwiła rekonstrukcję trójwymiarową sieci kanalików T i kwantyfikacji rozmiaru i rozmieszczenia kanalików T, a ważne związki między kanalikami T a uwalnianiem wapnia zaczęły być wyjaśniane wraz z odkryciem iskier wapniowych . Podczas gdy wczesne prace koncentrowały się na mięśniu sercowym komorowym i mięśniu szkieletowym, w 2009 roku zaobserwowano rozległą sieć kanalików T w komórkach mięśnia sercowego przedsionka. Trwające badania skupiają się na regulacji struktury kanalików T oraz na tym, jak kanaliki T wpływają i przyczyniają się do chorób sercowo-naczyniowych.
Znaczenie kliniczne
Choroba może zmienić strukturę kanalików T, co w sercu może przyczynić się do osłabienia mięśnia sercowego lub zaburzeń rytmu serca. Zmiany obserwowane w chorobie wahają się od całkowitej utraty kanalików T do bardziej subtelnych zmian w ich orientacji lub wzorcach rozgałęzień. Kanaliki T mogą zostać utracone lub uszkodzone po zawale mięśnia sercowego , a także w komorach u pacjentów z niewydolnością serca , przyczyniając się do zmniejszenia siły skurczu i potencjalnie zmniejszając szanse na wyzdrowienie. Niewydolność serca może również powodować prawie całkowitą utratę kanalików T z przedsionkowych kardiomiocytów, zmniejszając kurczliwość przedsionków i potencjalnie przyczyniając się do migotania przedsionków .
Zmiany strukturalne w kanalikach T mogą prowadzić do odsuwania się kanałów wapniowych typu L od receptorów rianodyny. Może to wydłużyć czas potrzebny do wzrostu poziomu wapnia w komórce, prowadząc do słabszych skurczów i arytmii . Jednak nieuporządkowana struktura kanalików T może nie być trwała, ponieważ niektórzy sugerują, że przebudowę kanalików T można odwrócić poprzez zastosowanie treningu interwałowego .
