Liaza amoniakalna treoniny - Threonine ammonia-lyase
| Liaza amoniakalna L-treoniny | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Trójwymiarowy rysunek przedstawiający tetramer deaminazy treoniny
| |||||||||
| Identyfikatory | |||||||||
| Nr WE | 4.3.1.19 | ||||||||
| Bazy danych | |||||||||
| IntEnz | Widok IntEnz | ||||||||
| BRENDA | Wpis BRENDY | ||||||||
| ExPASy | Widok NiceZyme | ||||||||
| KEGG | Wpis KEGG | ||||||||
| MetaCyc | szlak metaboliczny | ||||||||
| PRIAM | profil | ||||||||
| Struktury WPB | RCSB PDB PDBe Suma PDB | ||||||||
| Ontologia genów | AmiGO / QuickGO | ||||||||
| |||||||||
Amoniaza treoninowa , zwana również potocznie deaminazą treoniną lub dehydratazą treoniną , jest enzymem odpowiedzialnym za katalizowanie przemiany L-treoniny w alfa-ketomaślan i amoniak . Alfa-ketomaślan może zostać przekształcony w L-izoleucynę , dzięki czemu liaza amoniakalna treoniny działa jako kluczowy enzym w syntezie BCAA . Wykorzystuje kofaktor pirydoksalo-5'-fosforanowy , podobny do wielu enzymów biorących udział w metabolizmie aminokwasów . Występuje w bakteriach , drożdżach i roślinach , chociaż większość dotychczasowych badań skupiała się na formach tego enzymu w bakteriach. Enzym ten był jednym z pierwszych, w których hamowanie ujemnego sprzężenia zwrotnego przez produkt końcowy szlaku metabolicznego było bezpośrednio obserwowane i badane. Enzym stanowi doskonały przykład strategii regulacyjnych stosowanych w homeostazie aminokwasów .
Struktura
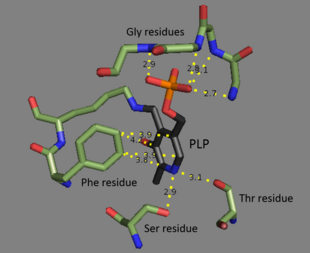
Liaza amoniakalna treoniny jest tetramerem identycznych podjednostek i jest ułożona jako dimer dimerów. Każda podjednostka ma dwie domeny : domenę zawierającą katalityczne miejsce aktywne i domenę z allosterycznymi miejscami regulatorowymi. Wykazano, że te dwa regiony są odrębnymi regionami, ale miejsce regulatorowe jednej podjednostki faktycznie oddziałuje z miejscem katalitycznym innej podjednostki. Obie domeny zawierają powtarzający się motyw strukturalny arkuszy beta otoczonych przez alfa helisy . Chociaż miejsce wiązania treoniny nie jest doskonale poznane, badania strukturalne ujawniają, w jaki sposób jest związany kofaktor fosforanu pirydoksalu. Kofaktor PLP jest związany z resztą lizyny za pomocą zasady Schiffa , a grupa fosforanowa PLP jest utrzymywana na miejscu przez grupy aminowe pochodzące z powtarzającej się sekwencji reszt glicyny . Aromatyczny pierścień jest związany z fenyloalaniny , a atom azotu w pierścieniu jest atom wodoru związany z hydroksylowych reszt zawierających grupy.
Mechanizm
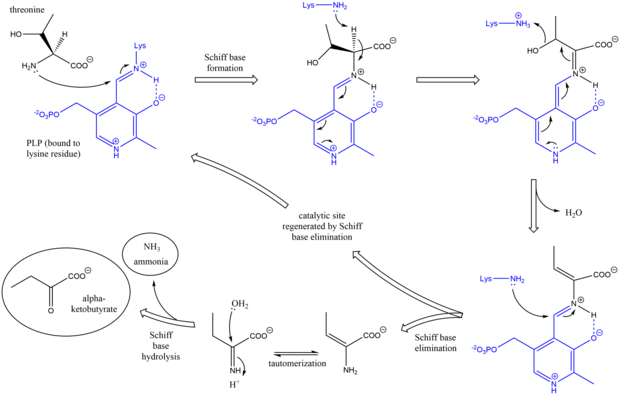
Mechanizm działania amoniakalnej liazy treoninowej jest analogiczny do innych enzymów dezaminujących PLP w zastosowaniu półproduktów zasady Schiffa . Początkowo grupa aminowa treoniny atakuje zasadę Schiffa lizyna/PLP, wypierając lizynę. Po deprotonacji węgla alfa aminokwasu, a następnie odwodnieniu (stąd nazwa zwyczajowa dehydrataza treoninowa ) powstaje nowa zasada Schiffa. Ta zasada Schiffa jest zastąpiona atakiem lizyny, reformując aktywny katalitycznie PLP i uwalniając początkowy produkt zawierający alken . Ten produkt ulega tautomeryzacji i po hydrolizie zasady Schiffa powstają produkty końcowe. Po wytworzeniu końcowego produktu alfa-ketomaślanowego, izoleucyna jest syntetyzowana poprzez przejście przez półprodukty alfa-acetohydroksymaślanu do alfa-beta-dihydroksy-beta-metylowalerianianu, a następnie do alfa-keto-beta-metylowalerianianu.
Rozporządzenie
Wykazano, że liaza amoniakalna treoniny nie podlega kinetyce Michaelisa-Mentena , a raczej podlega złożonej kontroli allosterycznej. Enzym jest hamowany przez izoleucynę, produkt szlaku, w którym uczestniczy, i jest aktywowany przez walinę , produkt szlaku równoległego. Zatem wzrost stężenia izoleucyny wyłącza jej produkcję, a wzrost stężenia waliny odwraca materiał wyjściowy (hydroksyetylo- TPP ) z produkcji waliny. Enzym posiada dwa miejsca wiązania izoleucyny; jeden ma wysokie powinowactwo do izoleucyny, a drugi ma niskie powinowactwo. Wiązanie izoleucyny z miejscem o wysokim powinowactwie zwiększa powinowactwo wiązania z miejscem o niskim powinowactwie, a dezaktywacja enzymu następuje, gdy izoleucyna wiąże się z miejscem o niskim powinowactwie. Walina promuje aktywność enzymów poprzez konkurencyjne wiązanie się z miejscem o wysokim powinowactwie, zapobiegając hamującemu działaniu izoleucyny. Połączenie tych dwóch metod sprzężenia zwrotnego równoważy stężenie BCAA.
Izoformy i inne funkcje
W różnych gatunkach organizmów zaobserwowano wiele form amoniakliazy treoniny . W Escherichia coli , układzie, w którym enzym był intensywnie badany, występują dwie różne formy tego enzymu. Jeden jest biosyntetyczny i przypomina przedstawione tutaj właściwości enzymów, podczas gdy drugi jest rozkładem i działa w celu generowania fragmentów węgla do produkcji energii . Parę izoform zaobserwowano również u innych bakterii. U wielu bakterii ulegająca biodegradacji izoforma enzymu ulega ekspresji w warunkach beztlenowych i jest promowana przez cAMP i treoninę, podczas gdy izoforma biosyntetyczna ulega ekspresji w warunkach tlenowych . Pozwala to bakterii zrównoważyć zapasy energii i hamować energochłonne szlaki syntetyczne, gdy energia nie jest obfita.
W roślinach amoniakliaza treoninowa jest ważna w mechanizmach obronnych przed roślinożercami i jest regulowana w górę w odpowiedzi na stres abiotyczny . Zaadaptowana izoforma enzymu o unikalnych właściwościach odstraszających roślinożerców jest wyrażana w liściach roślin. Domena katalityczna tej izoformy jest niezwykle odporna na proteolizę , podczas gdy domena regulatorowa łatwo ulega degradacji, więc po spożyciu przez inny organizm zdolność enzymu do deaminacji treoniny pozostaje niesprawdzona. To degraduje treoninę, zanim roślinożerca może ją wchłonąć, pozbawiając roślinożercy niezbędnego aminokwasu . Badania nad amoniakoliazą treoniną w roślinach zaoferowały również nowe strategie rozwoju GMO o zwiększonej wartości odżywczej poprzez zwiększenie zawartości niezbędnych aminokwasów.
Odkryto inne, bardziej egzotyczne formy enzymu, które są niezwykle małe, ale nadal zachowują wszystkie funkcje katalityczne i regulacyjne.
Ewolucja
Istnieje pięć głównych typów fałdowania enzymów zależnych od PLP. Liaza amoniakalna treoniny jest członkiem rodziny Fold Type II, znanej również jako rodzina syntazy tryptofanu . Chociaż amoniakliaza treoninowa nie posiada tunelowania substratu, jak ma to miejsce w przypadku syntazy tryptofanu, zawiera dużo zachowaną homologię . Amoniakoliaza treoninowa jest najbliżej spokrewniona z dehydratazą serynową i obie mają ten sam ogólny mechanizm katalityczny. W rzeczywistości wykazano, że amoniakliaza treoninowa wykazuje pewną specyficzność wobec seryny i może przekształcać serynę w pirogronian . Domena regulatorowa amoniakoliazy treoninowej jest bardzo podobna do domeny regulatorowej dehydrogenazy fosfoglicerynianowej . Wszystkie te zależności pokazują, że amoniakliaza treoninowa ma ścisłe powiązania ewolucyjne z tymi enzymami. Ze względu na stopień konserwatywnej struktury i sekwencji w enzymach rozpoznających aminokwasy, prawdopodobne jest, że ewolucyjna różnorodność tych enzymów powstała w wyniku dopasowania ze sobą poszczególnych domen regulatorowych i katalitycznych na różne sposoby.
Znaczenie dla ludzi
Liaza amoniakalna treoniny nie występuje u ludzi. Jest to zatem jeden z przykładów, dlaczego ludzie nie potrafią syntetyzować wszystkich 20 aminokwasów proteinogennych ; w tym konkretnym przypadku ludzie nie mogą przekształcić treoniny w izoleucynę i muszą spożywać izoleucynę w diecie. Enzym był również badany w przeszłości jako możliwy czynnik hamujący nowotwór z wcześniej opisanych powodów, ponieważ pozbawia komórki nowotworowe niezbędnego aminokwasu i zabija je, ale tego leczenia nie stosowano.