Chlorek tris(bipirydyno)rutenu(II) - Tris(bipyridine)ruthenium(II) chloride
|
|

|
|

|
|
| Nazwy | |
|---|---|
| Inne nazwy
Ru-bpy Dichlorek
tris(2,2'-bipirydylu) rutenu |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA |
100.034.772 |
| Numer WE | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 30 H 24 N 6 Cl 2 Ru x 6 2 O | |
| Masa cząsteczkowa | 640,53 g/mol (bezwodny) 748,62 g/mol (sześciowodny) |
| Wygląd zewnętrzny | czerwone ciało stałe |
| Gęstość | solidny |
| Temperatura topnienia | >300 °C |
| słabo rozpuszczalny w wodzie; rozpuszczalny w acetonie | |
| Struktura | |
| Oktaedry | |
| 0 D | |
| Zagrożenia | |
| Główne zagrożenia | umiarkowanie toksyczny |
| Arkusz danych dotyczących bezpieczeństwa | Zewnętrzna Karta Charakterystyki |
| Zwroty R (nieaktualne) | Żaden |
| Zwroty S (nieaktualne) | S22 S24/25 |
| Związki pokrewne | |
|
Związki pokrewne
|
Trichlorek rutenu 2,2'-bipirydyna |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
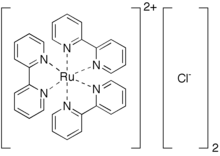
Chlorek tris(bipirydyno)rutenu(II) jest kompleksem koordynacyjnym soli chlorkowej o wzorze [Ru(bpy) 3 ] 2+ 2Cl − . Ten kompleks polipirydynowy jest czerwoną krystaliczną solą otrzymywaną jako heksahydrat , chociaż wszystkie interesujące właściwości dotyczą kationu [Ru(bpy) 3 ] 2+ , któremu poświęcono wiele uwagi ze względu na swoje charakterystyczne właściwości optyczne. Chlorki można zastąpić innymi anionami , takimi jak PF 6 − .
Synteza i struktura

Sól wytwarza się przez działanie na wodny roztwór trichlorku rutenu z 2,2'-bipirydyny . W tej konwersji Ru(III) jest redukowany do Ru(II), a kwas podfosforawy jest zazwyczaj dodawany jako środek redukujący. [Ru (bpy) 3 ] 2+ znaczy ośmiościenny, zawierające centralny niskiej wirowania d 6 Ru (ll), a trzy z użyciem dwukleszczowych ligandów BPY. Odległości Ru-N wynoszą 2.053(2) , krótsze niż odległości Ru-N dla [Ru(bpy) 3 ] 3+ . Kompleks jest chiralny, gdzie D 3 symetrii . Została rozłożona na enancjomery . W najniższym leżącego trypletowego stanu wzbudzonego cząsteczki uważa się, że osiągną dolną C 2 symetrię jak wzbudzony elektron jest zlokalizowany głównie w jednym bipirydyl ligandu.
Fotochemia [Ru(bpy) 3 ] 2+
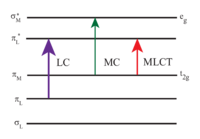
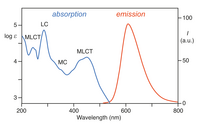
[Ru(bpy) 3 ] 2+ pochłania światło ultrafioletowe i widzialne. Wodne roztwory [Ru (bpy) 3 ] CI 2 pomarańczy powodu silnego MLCT absorpcji przy 452 ± 3 nm ( współczynnik ekstynkcji w 14.600 M -1 cm -1 ). Dalsze pasma absorpcji znajdują się przy 285 nm, co odpowiada przejściom π * ← π z centrum liganda i słabemu przejściu około 350 nm (przejście dd). Absorpcja światła skutkująca powstaniem stanu wzbudzonego ma stosunkowo długi czas życia wynoszący 890 ns w acetonitrylu i 650 ns w wodzie. Stan wzbudzony relaksuje się do stanu podstawowego poprzez emisję fotonu lub relaksację bezpromienistą. Wydajność kwantowa wynosi 2,8% w wodzie nasyconej powietrzem w temperaturze 298 K, a maksimum emisji o długości fali 620 nm. Długi czas życia stanu wzbudzonego przypisuje się temu, że jest on trypletem , natomiast stan podstawowy jest stanem singletowym, a po części dzięki temu, że budowa cząsteczki pozwala na rozdzielenie ładunku. Przejścia singlet-tryplet są zabronione i dlatego często są powolne .
Jak wszystkie molekularne stany wzbudzone, stan wzbudzony tripletowy [Ru(bpy) 3 ] 2+ ma zarówno silniejsze właściwości utleniające, jak i redukujące niż stan podstawowy. Taka sytuacja ma miejsce, ponieważ stan wzbudzony można opisać jako kompleks Ru 3+ zawierający jako ligand anion rodnikowy bpy •− . Zatem właściwości fotochemiczne [Ru(bpy) 3 ] 2+ przypominają montaż fotosyntetyczny , który obejmuje również oddzielenie elektronu i dziury .
[Ru(bpy) 3 ] 2+ został zbadany jako fotosensybilizator zarówno pod kątem utleniania, jak i redukcji wody. Po zaabsorbowaniu fotonu, [Ru(bpy) 3 ] 2+ przekształca się we wspomniany stan trypletowy, oznaczony jako [Ru(bpy) 3 ] 2+ *. Ten rodzaj przenosi elektron, znajdujący się na jednym ligandzie bpy, do utleniacza protektorowego, takiego jak nadtlenodisiarczan (S 2 O 8 2- ). Uzyskany [Ru (bpy) 3 ] 3+ jest silnym utleniaczem i utlenia się wodę do O 2 i protonów poprzez katalizator . Alternatywnie, moc redukującą [Ru(bpy) 3 ] 2+ * można wykorzystać do redukcji metyloviologenu , nadającego się do recyklingu nośnika elektronów, który z kolei redukuje protony na katalizatorze platynowym . Aby proces ten był katalityczny, stosuje się protektorowy reduktor, taki jak EDTA 4- lub trietanoloamina, aby przywrócić Ru(III) z powrotem do Ru(II).
Pochodne [Ru(bpy) 3 ] 2+ są liczne. Takie kompleksy są szeroko dyskutowane pod kątem zastosowań w biodiagnostyce, fotowoltaice i organicznych diodach elektroluminescencyjnych , ale żadna pochodna nie została skomercjalizowana. Zastosowanie [Ru(bpy) 3 ] 2+ i jego pochodnych do wytwarzania optycznych czujników chemicznych jest prawdopodobnie jednym z najbardziej udanych dotychczas obszarów.
[Ru(bpy) 3 ] 2+ i kataliza fotoredoks
Kataliza fotoredoks wykorzystuje [Ru(bpy) 3 ] 2+ jako uczulacz jako strategię syntezy organicznej. Stosuje się również wiele analogów [Ru(bpy) 3 ] 2+ . Przekształcenia te wykorzystują właściwości redoks [Ru(bpy) 3 ] 2+ * i jego redukcyjnie wygaszonej pochodnej [Ru(bpy) 3 ] + .
Bezpieczeństwo
Metal-bipirydyna, jak również pokrewne kompleksy fenantroliny są ogólnie bioaktywne, ponieważ mogą działać jako środki interkalujące .