Jon karbenu - Carbenium ion
Jonów karbeniowy jest dodatni z RR'R struktura "C + , to jest związki chemiczne z trójwartościowym atomem węgla noszącym +1 ładunek formalnych .
W starszej literaturze dla tej klasy używano nazwy jon węgla , ale obecnie odnosi się ona wyłącznie do innej rodziny karbokationów , jonów węgla , gdzie naładowany węgiel jest pięciowartościowy . Obecne definicje zostały zaproponowane przez chemika George'a Andrew Olaha w 1972 roku i są obecnie powszechnie akceptowane.
Jony karbenowe są na ogół bardzo reaktywne ze względu na niekompletny oktet elektronów; jednak niektóre jony karbenowe, takie jak jon tropiliowy , są stosunkowo stabilne ze względu na delokalizację ładunku dodatniego między atomami węgla.
Nomenklatura
Jony karbenu są klasyfikowane jako pierwszorzędowe , drugorzędowe lub trzeciorzędowe w zależności od tego, czy liczba atomów węgla związanych z węglem zjonizowanym wynosi 1, 2 czy 3. (jony z zerowym atomem węgla przyłączone do zjonizowanego węgla, takie jak meten , CH+
3, są zwykle zaliczane do klasy podstawowej).
Reaktywność
Stabilność zazwyczaj wzrasta wraz z liczbą grup alkilowych związanych z węglem niosącym ładunek. Karbokationy trzeciorzędowe są bardziej stabilne (i łatwiej się tworzą) niż karbokationy wtórne, ponieważ są stabilizowane przez hiperkoniugację . Karbokationy pierwotne są bardzo niestabilne. W związku z tym reakcje takie jak reakcja S N 1 i reakcja eliminacji E1 zwykle nie zachodzą, jeśli powstałby pierwszorzędowy karben.
Jednak węgiel podwójnie związany z węglem zjonizowanym może stabilizować jon przez rezonans . Takie kationy jak kation allilowy CH
2=CH−CH+
2, oraz kation benzylowy , C
6h
5−CH+
2, są bardziej stabilne niż większość innych karbokationów. Szczególnie reaktywne są cząsteczki, które mogą tworzyć karbeny allilowe lub benzylowe. Jony karbenu mogą być również stabilizowane przez heteroatomy .
Jony karbeniowy można poddać reakcji przegrupowania z mniej stabilnych struktur do jednakowo stałych lub bardziej stabilne te o stałej szybkości powyżej 10 9 S -1 . Fakt ten komplikuje ścieżki syntezy wielu związków. Na przykład, gdy pentan-3-ol ogrzewa się z wodnym roztworem HCl, początkowo wytworzona karbokation 3-pentylu przekształca się w statystyczną mieszaninę 3-pentylu i 2-pentylu. Te kationy reagują z jonem chlorkowym, tworząc 3-chloropentan i 2-chloropentan w stosunku około 1:2.
Rodzaje jonów karbenu
Jony alkilowe
Jony karbenu można otrzymać bezpośrednio z alkanów poprzez usunięcie anionu wodorkowego H−
, z mocnym kwasem. Na przykład magiczny kwas , mieszanina pentafluorku antymonu ( SbF
5) i kwas fluorosiarkowy ( FSO
3H ), zamienia izobutan w kation trimetylokarbenium (CH
3)
3C+
.
Aromatyczne jony karbenu
Jonów tropylium stanowi aromatyczne substancje o wzorze C
7h+
7. Jego nazwa wywodzi się od cząsteczki tropiny (sama nazwana na cześć cząsteczki atropina ). Sole kationu tropiliowego mogą być trwałe, np . tetrafluoroboran tropiliowy . Może być wykonany z cykloheptatrienu (tropilidenu) i pięciochlorku bromu lub fosforu
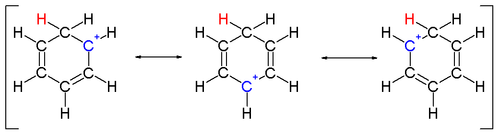
Jest to płaski, cykliczny, siedmiokątny jon; ma również 6 elektronów π (4 n + 2, gdzie n = 1), co spełnia zasadę aromatyczności Hückela . Może koordynować jako ligand do atomów metali .
Pokazana struktura jest złożeniem siedmiu wkładów rezonansowych, w których każdy węgiel przenosi część ładunku dodatniego.
W 1891 G. Merling otrzymał rozpuszczalną w wodzie sól z reakcji cykloheptatrienu i bromu. Struktura została wyjaśniona przez Eggersa Doeringa i Knoxa w 1954 roku.
Innym aromatycznym jonem karbenowym jest jon cyklopropenylowy lub cyklopropenowy , C
3h+
3, otrzymany przez Ronalda Breslowa i Johna T. Grovesa w 1970 roku. Chociaż jest mniej stabilny niż kation tropiliowy, ten jon karbenowy może również tworzyć sole w temperaturze pokojowej. Breslow i Groves odkryli, że roztwory takich soli mają właściwości spektroskopowe i chemiczne odpowiadające oczekiwaniom dla aromatycznego jonu karbenu.
Kation trifenylometylu (tritylu)
Trifenylokarboniowe lub trifenylometyl kation [C (
6h
5)
3]+
, jest szczególnie stabilny, ponieważ ładunek dodatni może być rozłożony na 10 atomów węgla (3 atomy węgla w pozycjach orto i para każdej z trzech grup fenylowych plus centralny atom węgla). Występuje w związkach heksafluorofosforanu trifenylometylu [C(C
6h
5)
3]+
[PF
6]−
, tetrafluoroboran trifenylometylu [C(C
6h
5)
3]+
[BF
4]−
, oraz nadchloran trifenylometylu [C(C
6h
5)
3]+
[ClO
4]−
. Jego pochodne obejmują barwniki triarylometanowe .
Jony arenu

Jonów arenium oznacza kation cykloheksadienyl, który pojawia się jako reaktywny związek pośredni w elektrofilowego podstawienia aromatycznego . Ze względów historycznych kompleks ten nazywany jest również pośrednim Whelandem lub kompleksem σ .
Dwa atomy wodoru związane z jednym węglem leżą w płaszczyźnie prostopadłej do pierścienia benzenowego. Jon arenium nie jest już gatunkiem aromatycznym; jednak jest stosunkowo stabilny ze względu na delokalizację: ładunek dodatni jest delokalizowany na 5 atomach węgla poprzez układ π , jak pokazano na następujących strukturach rezonansowych :
Innym wkładem w stabilność jonów arenu jest przyrost energii wynikający z silnego wiązania między benzenem a skompleksowanym elektrofilem.
Najmniejszym jonem arenu jest protonowany benzen , C
6h+
7. Jonów benzenium można wydzielić jako związek trwały, jeśli benzen protonowane przez superkwas karboran H (CB 11 H (CH 3 ) 5 Br 6 ). Sól benzenowa jest krystaliczna o stabilności termicznej do 150°C. Długości wiązań wydedukowane z krystalografii rentgenowskiej są zgodne ze strukturą kationu cykloheksadienylowego.
Jony acylowe
Jonów acylium oznacza kation o wzorze RCO + . Struktura jest opisana jako R−C≡O + lub R−=O. Jest to syntetyczny i reaktywny odpowiednik karbokationu acylowego, ale rzeczywista struktura ma tlen i węgiel połączone wiązaniem potrójnym. Takie gatunki są powszechnymi reaktywnymi pośrednikami, na przykład w acylacji Friedel-Craftsa, a także w wielu innych reakcjach organicznych, takich jak przegrupowanie Hayashi . Sole zawierające jony acylowe mogą być generowane przez usunięcie halogenku z halogenków acylowych :
- RCOCl + SbCl 5 → RCO + SbCl−
6
Odległość C–O w tych kationach jest bliska 1,1 angströma , a nawet krótsza niż w przypadku tlenku węgla . Kationy Acylium są charakterystyczne fragmenty obserwowane w EI- widm masowych z ketonów .