Azotan cerowo-amonowy - Ceric ammonium nitrate

|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Azotan diamonowo-cerowy(IV)
|
|
| Inne nazwy
Azotan cerowo-amonowy (CAN)
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChemSpider | |
| Karta informacyjna ECHA |
100.037.100 |
| Numer WE | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| H 8 N 8 CeO 18 | |
| Masa cząsteczkowa | 548,218 g·mol -1 |
| Wygląd zewnętrzny | pomarańczowo-czerwone kryształy |
| Temperatura topnienia | 107 do 108 °C (225 do 226 °F; 380 do 381 K) |
| 141 g/100 ml (25°C) 227 g/100 ml (80°C) |
|
| Struktura | |
| Jednoskośny | |
| Icosahedral | |
| Zagrożenia | |
| Piktogramy GHS |
 
|
| Hasło ostrzegawcze GHS | Zagrożenie |
| H272 , H302 , H315 , H319 , H335 | |
| P220 , P261 , P305 + 351 + 338 | |
| Związki pokrewne | |
|
Związki pokrewne
|
Azotan amonu Tlenek ceru(IV) |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
| Referencje do infoboksu | |
Azotan amonowo-cerowy (CAN) jest związkiem nieorganicznym o wzorze ( NH 4 ) 2 Ce(NO 3 ) 6 . Ta pomarańczowo-czerwona, rozpuszczalna w wodzie sól ceru jest specjalistycznym utleniaczem w syntezie organicznej i standardowym utleniaczem w analizie ilościowej .
Przygotowanie, właściwości i struktura
Anionu [Ce (NO
3)
6]2-
powstaje przez rozpuszczenie Ce
2O
3w gorącym stężonym HNO 3 .
Sól składa się z anionu [Ce(NO
3)
6]2-
oraz parę NH 4 + przeciwjonów. Jony amonowe nie biorą udziału w reakcjach utleniania tej soli. W anionie każda grupa azotanowa chelatuje atom ceru w sposób dwukleszczowy , jak pokazano poniżej:
Anion [Ce(NO
3)
6]2-
ma symetrię molekularną T h (wyidealizowanej O h ) . Rdzeń CeO 12 definiuje dwudziestościan .
Ce 4+ jest silnym utleniaczem jednoelektronowym . Pod względem potencjału redoks (E° ~ 1,61 V vs. NHE) jest jeszcze silniejszym środkiem utleniającym niż Cl 2 (E° ~ 1,36 V). Niewiele odczynników o długim okresie przydatności do spożycia jest silniejszymi utleniaczami. W procesie redoks Ce(IV) jest przekształcane w Ce(III), jednoelektronowa zmiana, sygnalizowana blaknięciem koloru roztworu z pomarańczowego do jasnożółtego (pod warunkiem, że substrat i produkt nie są silnie zabarwione).
Zastosowania w chemii organicznej
W syntezie organicznej CAN jest użyteczny jako utleniacz dla wielu grup funkcyjnych ( alkohole , fenole i etery ) oraz wiązań CH, zwłaszcza tych, które są benzylowe. Alkeny ulegają dinitoksylacji, chociaż wynik jest zależny od rozpuszczalnika. Chinony są produkowane z katecholi i hydrochinonów, a nawet nitroalkany są utleniane.
CAN stanowi alternatywę dla reakcji Nef ; na przykład do syntezy ketomakrolidu, gdzie komplikujące reakcje uboczne zwykle napotyka się przy użyciu innych odczynników. Utleniające halogenowanie może być promowane przez CAN jako utleniacz in situ w bromowaniu benzylowym i jodowaniu ketonów i pochodnych uracylu .
Do syntezy heterocykli
Katalityczne ilości wodnego CAN umożliwiają wydajną syntezę pochodnych chinoksaliny . Chinoksaliny są znane ze swoich zastosowań jako barwniki, półprzewodniki organiczne i środki rozszczepiające DNA. Pochodne te są również składnikami antybiotyków, takich jak echinomycyna i aktynomycyna . Katalizowana przez CAN trójskładnikowa reakcja pomiędzy anilinami i eterami alkilowo-winylowymi zapewnia wydajne wejście w 2-metylo-1,2,3,4-tetrahydrochinoliny i odpowiadające im chinoliny otrzymane przez ich aromatyzację .
Jako odczynnik odbezpieczający
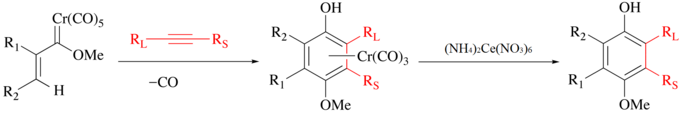
CAN jest tradycyjnie używany do uwalniania organicznych ligandów z karbonylków metali . W tym procesie metal ulega utlenieniu, wydziela się CO, a organiczny ligand jest uwalniany do dalszej manipulacji. Na przykład w reakcji Wulffa-Dötza alkin, tlenek węgla i karben chromu są łączone w celu utworzenia kompleksu pół-kanapki chromu, a ligand fenolowy można wyizolować przez łagodne utlenianie CAN.
CAN służy do rozszczepiania eterów para- metoksybenzylowych i 3,4-dimetoksybenzylowych, które są grupami zabezpieczającymi alkohole. Na każdy równoważnik eteru para- metoksybenzylowego wymagane są dwa równoważniki CAN . Alkohol jest uwalniany, a eter para- metoksybenzylowy przekształca się w para- metoksybenzaldehyd. Zrównoważone równanie wygląda następująco:
- 2 (NH 4 ) 2 Ce(NO 3 ) 6 + H 3 COC 6 H 4 CH 2 OR + H 2 O → 4 NH 4 + + 2 Ce 3+ + 12 NO 3 − + 2 H + + H 3 COC 6 H 4 CHO + POZ
Inne aplikacje
CAN jest również składnikiem wytrawiacza chromowego , materiału używanego do produkcji fotomasek i wyświetlaczy ciekłokrystalicznych .