Hesperydyna - Hesperidin
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
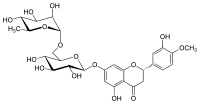
( 2S )-3′,5-dihydroksy-4′-metoksy-7-[α- L- ramnopiranozylo-(1→6) -β- D- glukopiranozyloksy]flawan-4-on
|
|
|
Preferowana nazwa IUPAC
(2 2 S ,4 2 S ,4 3 R ,4 4 S ,4 5 S ,4 6 R ,7 2 R ,7 3 R ,7 4 R ,7 5 R ,7 6 S )-1 3 ,2 5 4 3 4 4 4 5 7 3 7 4 7 5 -Octahydroxy-1 4 -metoksy-7 6 -metylo-2 2 2 3 -dihydro-2 4 H 3,6-dioksa 2(2,7)-[1]benzopirana-4(2,6),7(2)-bis(oksana)-1(1)-benzenaheptafan-2 4 -on |
|
| Inne nazwy
7-rutynozyd hesperetyny
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.007.536 |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 28 H 34 O 15 | |
| Masa cząsteczkowa | 610,565 g·mol -1 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Hesperydyna to glikozyd flawanonowy występujący w owocach cytrusowych . Jego forma aglikonowa nazywana jest hesperetyną . Jego nazwa pochodzi od słowa „ hesperidium ”, oznaczającego owoce wytwarzane przez drzewa cytrusowe.
Hesperydyna została po raz pierwszy wyizolowana w 1828 roku przez francuskiego chemika Lebretona z białej wewnętrznej warstwy skórek cytrusowych (mezokarp, albedo).
Uważa się, że hesperydyna odgrywa rolę w obronie roślin .
Źródła
Rutaceae
- 700 - 2500 ppm w owocach Citrus aurantium L. - Gorzka Pomarańcza, Petitgrain
- w soku pomarańczowym ( Citrus sinensis )
- w Zanthoxylum gilletii
- w cytrynie
- w limonce
- w liściach Agathosma serratifolia
Lamiaceae
Mięta pieprzowa zawiera hesperydynę.
Zawartość w żywności
Przybliżona zawartość hesperydyny w 100 ml
- 481 mg mięty pieprzowej, suszonej
- 44 mg czerwonej pomarańczy , czysty sok
- 26 mg pomarańczy , czysty sok
- 18 mg cytryny , czysty sok
- 14 mg limonki , czysty sok
- 1 mg grejpfruta , czysty sok
Metabolizm
Hesperydyna 6-O-a-L-rhamnosyl-beta-D-glukozydazy , enzym zastosowania hesperydyny i H 2 O W celu wytworzenia hesperetyna i rutynoza , znajduje się w Ascomycetes gatunków.
Badania
Jako flawanon znajdujący się w skórkach owoców cytrusowych (takich jak pomarańcze czy cytryny), hesperydyna jest poddawana wstępnym badaniom pod kątem możliwych właściwości biologicznych in vivo . W jednym przeglądzie nie znaleziono dowodów na to, że hesperydyna wpływa na poziom lipidów we krwi lub nadciśnienie . W innym przeglądzie stwierdzono, że hesperydyna może poprawiać funkcję śródbłonka u ludzi, ale ogólne wyniki były niejednoznaczne.
Biosynteza
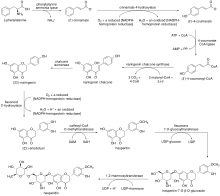
Biosynteza hesperydyny wywodzi się ze szlaku fenylopropanoidowego , w którym naturalny aminokwas L- fenyloalanina ulega deaminacji przez liazę amoniakalną fenyloalaniny z wytworzeniem ( E ) - cynamonianu . Otrzymany monokarboksylan ulega utlenieniu przez 4-hydroksylazę cynamonową z wytworzeniem ( E )-4-kumaranu, który jest przekształcany w ( E )-4-kumaroilo-CoA przez ligazę 4-kumaranowo-CoA . ( E )-4-kumaroilo-CoA poddaje się następnie syntazie poliketydowej naringenino-chalkonu typu III , przechodząc kolejne reakcje kondensacji i ostatecznie kondensację Claisena z zamknięciem pierścienia z wytworzeniem chalkonu naringeniny . Odpowiedni chalkon ulega izomeryzacji przez izomerazę chalkonową z wytworzeniem ( 2S )-naringeniny , która jest utleniana do ( 2S )-eriodiktiolu przez 3'-hydroksylazę flawonoidową . Po O- metylacji przez O- metylotransferazę kofeoilo-CoA , produkt hesperytynowy ulega glikozylacji przez 7- O- glukozylotransferazę flawanono-, z wytworzeniem 7- O -β-D-glukozydu hesperytyny . Na koniec ugrupowanie ramnozylowe jest wprowadzane do monoglikozylowanego produktu przez 1,2-ramnozylotransferazę, tworząc hesperydynę.
Zobacz też
Bibliografia
Zewnętrzne linki
-
 Multimedia związane z hesperydyną w Wikimedia Commons
Multimedia związane z hesperydyną w Wikimedia Commons