Keto-enolowej - Keto–enol tautomerism
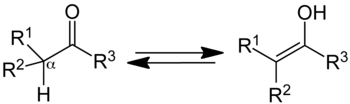
W chemii organicznej , keto-enol tautomeria odnosi się do równowagi chemicznej pomiędzy keto postaci (a ketonu lub aldehydu ) i enolowe (e alkoholu ). W enolowe i ketonowe formy są uważane tautomery siebie. Interkonwersję dwóch form obejmuje przemieszczanie na alfa atomie wodoru i reorganizacji wiążących elektrony ; Stąd izomeria zalicza się tautomerię.
Związek zawierające karbonylową grupę (C = O) jest zazwyczaj szybkim stanie równowagi z jego tautomerem enolu, który zawiera parę podwójnie połączonych atomach węgla sąsiadujących z grupą hydroksylową (-OH), grupy C = C-OH. Dominuje postać ketonowa w stanie równowagi dla większości ketony. Niemniej forma enolowa jest ważne dla niektórych reakcjach. Deprotonowanej pośredni interkonwersję dwóch formach, nazywany enolanu anionu , jest ważne w chemii karbonylową, w dużej mierze dlatego, że jest to silny nukleofil .
Zwykle keto-enolowa tautomeryzacja równowaga chemiczna jest wysoce napędzane termodynamicznie, a następnie w temperaturze pokojowej równowagę silnie sprzyja tworzeniu formy keto. Klasycznym przykładem sprzyjając formę ketonową można zobaczyć w równowadze pomiędzy alkoholu winylowego i aldehydu octowego (K = [enolu] / [keto] ≈ 3 x 10 -7 ). Jednakże, istnieją doniesienia, że w przypadku alkoholu winylowego , tworzenie stabilizowanej postaci enolu można osiągnąć przez regulację zawartości wody w systemie i stosując kinetyczny favorability na deuter wytwarza efekt izotopowy ( K H + / K D + = 4,75, K H 2 O / K D 2 O = 12). Stabilizacja deuterem można osiągnąć poprzez hydrolizę ketenu prekursora w obecności niewielkiego nadmiaru stechiometrycznego w ciężkiej wodzie (D 2 O). Badania pokazują, że proces tautomeryzacja jest znacząco hamowany, w temperaturze otoczenia ( k t ≈ 10 -6 m / s), a okres półtrwania w postaci enolu można łatwo zwiększyć do t 1/2 = 42 minut, dla pierwszego rzędu kinetyki hydrolizy.
Zawartość
Mechanizm
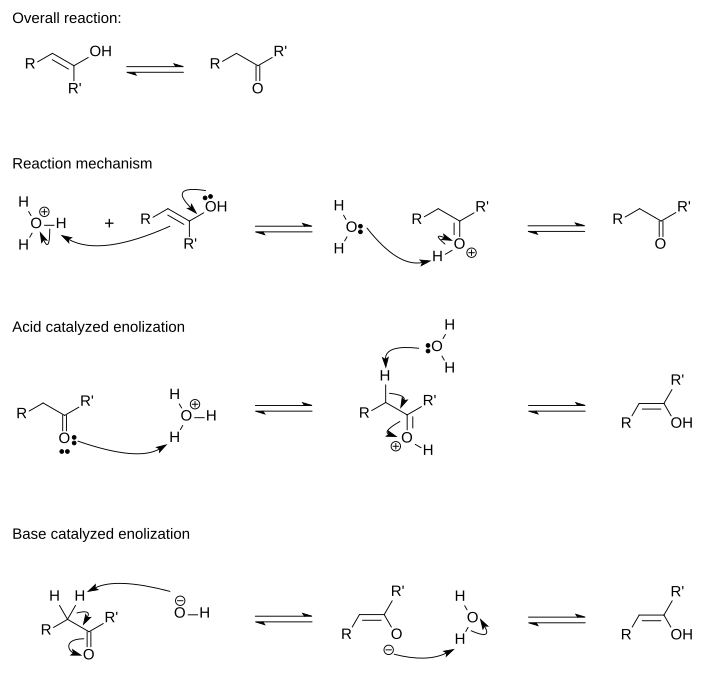
Katalizowanej kwasem konwersję enolu do wpływów postać ketonowa przez dwuetapowego mechanizmu w wodnym kwaśnym roztworze . W tym celu konieczne jest, aby alfa atomie węgla (atom węgla najbliżej grupy funkcyjnej) zawiera co najmniej jeden atom wodoru, znany jako alfa atomie wodoru. Ten alfa atom wodoru musi być dodatkowo umieszczone w taki sposób, że może wyrównać równolegle do antibonding PI orbitalnych karbonylowej grupy. Hyperconjugation tego wiązania z wiązaniem C-H przy atomie węgla alfa w zmniejsza gęstość elektronów w wiązania C-H i osłabia jej, co sprawia, atom wodoru a bardziej kwaśne. Gdy alfa atomie wodoru, który nie jest wyrównany z PI orbitalnej, na przykład w adamantanonu i inne wielopierścieniowe ketonów The enolizacji jest niemożliwe lub bardzo powoli.
W pierwszym etapie tego mechanizmu odsłonięte elektronów podwójne wiązania C = C enolu są oddawane do jonu hydroniowego (H 3 O + ). To dodawanie następujące reguły Markownikowa , tak protonu dodaje się do atomu węgla, bardziej przyłączone atomy wodoru. To wspólne etap z atomem tlenu w grupie hydroksylowej donora elektronów, w celu wytworzenia ostatecznego grupę karbonylową.
zasada Erlenmeyera
Jednym z pierwszych badaczy język ketoenolowa tautomerii był Emil Erlenmeyera . Jego zasada Erlenmeyera , opracowane w 1880, wskazuje, że wszystkie alkohole, w których grupa hydroksylowa jest przyłączona bezpośrednio do podwójnie związany atom węgla się aldehydy lub ketony. Przekształcenie to następuje, ponieważ forma ketonowa jest, na ogół, bardziej stabilne niż jego enolowego tautomeru. Forma keto więc uprzywilejowane w równowadze, ponieważ jest mniejsza forma energii.
Stereochemia ketonization
- Zobacz także: stereochemia ketonization z enole i enolanów
Gdy R 1 i R 2 (uwaga równanie na górze strony) to różne podstawniki, to jest nowe stereochemiczne utworzone w pozycji alfa, gdy enolowa przekształca się w jego formie ketonowej. W zależności od charakteru tych trzech grup R, uzyskane produkty w takiej sytuacji byłoby diastereoizomery lub enancjomery .
fenole
W niektórych związków aromatycznych, takich jak fenol , enolu jest ważne ze względu na aromatycznego charakteru enolu ale nie forma ketonowa. Topienia naftalenowy pochodnych kwasu naftaleno-1,4-diol, który ma 1,4-diolu, jako część aromatycznego pierścienia, w temperaturze 200 ° C prowadzi się mieszaninę 2: 1, z formą diketo, w którym pierścień z atomami tlenu stała niearomatyczne. Ogrzewanie formy diketoestru w benzenie w temperaturze 120 ° C przez trzy dni, również otrzymuje się mieszaninę (1: 1 reakcji pierwszego rzędu kinetyki). Produkt keto kinetycznie trwały i powraca do enolu w obecności zasady . Forma ketonowa może być otrzymany w postaci czystej przez mieszanie formę ketonową w kwasie trifluorooctowym i toluenu (1: 9), a następnie stosunek rekrystalizacji z eteru izopropylowego .
Gdy forma enolowa jest skompleksowany z chromu trikarbonylek całkowitą konwersję do postaci ketonowej przyspiesza i zachodzi nawet w temperaturze pokojowej w benzenie.
Znaczenie biochemii
Keto-enolowej jest ważne w wielu dziedzinach biochemii . Wysoki potencjał fosforan przelew z fosfoenolopirogronianu wynika z faktu, że związek jest fosforylowany „uwięziona” w termodynamicznie mniej korzystnej postaci enolowej, natomiast po defosforylacji może przyjąć formę ketonową. Rzadkie tautomery enolowe podstaw guanina i tymina może spowodować mutację z uwagi na ich zmienionych właściwości parowania zasad.
DNA
Keto-enolowa i imino-amino analogiczny tautomerii są jednymi z głównych przyczyn spontanicznych mutacji DNA podczas replikacji i naprawy. W kwas deoksyrybonukleinowy (DNA) na nukleotydów podstawy są zazwyczaj w postaci ketonowej, który jest stabilizowany przez wiązania wodorowe, które spaja się z dwóch nici DNA podwójnej helisy. Jednoniciowy DNA występuje przejściowo w trakcie replikacji i nie może nastąpić zmiana rzadkie postaci enolowej tyminy (T) albo guaniny (G). Jeżeli położenie podstawy enolu powtarzano, przed powrotem do konfiguracji ketonowych, wynik jest wbudowanie niedopasowane zasady. Na przykład, przesunięcie tautomeryczna keto-guaniny na enolowej guaniny (G *), powoduje, że parę z tyminą zamiast normalnego partnera cytozyny. Tautomeryczne przesunięcie jest przemijające, a po powrót do keto tworzą otrzymany niedopasowanych nukleotydów jest zwykle wykrywane i usuwane, ale w przypadku uszkodzenia DNA lub szybkiego powielania niedopasowanie może prowadzić do stałych zmian sekwencji, z mutacją przejściowego .
Pierwsze modele DNA zbudowane przez Jamesa Watsona i Francisa Cricka przewidywał podstaw, aby być w ich tautomerycznej postaci enolowej aż korygowane przez Jerry Donohue . To błędne zrozumienie opóźniony ich rozwiązywania struktury DNA aż poprawione. W konsekwencji, chociaż oni byli pierwszymi, którzy rozpoznają potencjalną rolę tautomerii w spontanicznej mutacji.
Zobacz też
- Geminalne diolem , inną postać ketonów i aldehydów w roztworach wodnych
- Selektywność