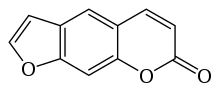
Psoralen - Psoralen
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
7 H furo [3,2- g ] [1] benzopirano-7-on |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 152784 | |
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.000.581 |
| Numer WE | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 11 H 6 O 3 | |
| Masa cząsteczkowa | 186,16 g/mol |
| Temperatura topnienia | 158 do 161 °C (316 do 322 °F; 431 do 434 K) |
| Zagrożenia | |
| Piktogramy GHS |

|
| Hasło ostrzegawcze GHS | Ostrzeżenie |
| H302 , H315 , H319 , H335 | |
| P261 , P264 , P270 , P271 , P280 , P301 + 312 , P302 + 352 , P304 + 340 , P305 + 351 + 338 , P312 , P321 , P330 , P332 + 313 , P337 + 313 , P362 , P403 + 233 , P405 , P501 | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Psoralen (zwany także psoralenem ) jest związkiem macierzystym z rodziny naturalnie występujących związków organicznych znanych jako liniowe furanokumaryny . Jest strukturalnie spokrewniony z kumaryną przez dodanie skondensowanego pierścienia furanowego i może być uważany za pochodną umbelliferonu . Psoralen występuje naturalnie w nasionach Psoralea corylifolia , jak również w figach pospolitych , selerze , pietruszce , drewnie zachodnioindyjskim oraz we wszystkich owocach cytrusowych . Jest szeroko stosowany w leczeniu PUVA (psoralen + UVA ) łuszczycy , egzemy , bielactwa i chłoniaka skórnego z komórek T ; aplikacje te są zazwyczaj związane z zastosowaniem leków, takich jak Metoxsalen . Wiele furanokumaryn jest wyjątkowo toksycznych dla ryb, a niektóre z nich są osadzane w strumieniach w Indonezji w celu połowu ryb.
Zastosowania
Psoralen jest mutagenem i jest wykorzystywany w tym celu w badaniach biologii molekularnej. Psoralen interkaluje do DNA i pod wpływem promieniowania ultrafioletowego (UVA) może tworzyć monoaddukty i kowalencyjne wiązania krzyżowe między nićmi (ICL) z tymiinami, preferencyjnie w miejscach 5'-TpA w genomie, indukując apoptozę . Terapię Psoralen plus UVA (PUVA) można stosować w leczeniu hiperproliferacyjnych chorób skóry, takich jak łuszczyca i niektóre rodzaje raka skóry . Niestety samo leczenie PUVA prowadzi do większego ryzyka raka skóry.
Ważnym zastosowaniem psoralenu jest leczenie PUVA problemów skórnych, takich jak łuszczyca oraz, w mniejszym stopniu, egzema i bielactwo nabyte . Wykorzystuje to wysoką absorpcję UV psoralenu. Psoralen nakłada się najpierw w celu uwrażliwienia skóry, a następnie stosuje się światło UVA w celu oczyszczenia problemu ze skórą. Psoralen jest również polecany w leczeniu łysienia . Psoraleny stosuje się również w fotoferezie , gdzie miesza się je z wyekstrahowanymi leukocytami przed zastosowaniem promieniowania UV.
Pomimo fotorakotwórczych właściwości psoralenu, do 1996 roku był używany jako aktywator opalania w filtrach przeciwsłonecznych. Psoraleny są używane w przyspieszaczach opalania, ponieważ psoralen zwiększa wrażliwość skóry na światło. Niektórzy pacjenci mieli poważną utratę skóry po opalaniu z aktywatorami opalania zawierającymi psoralen. Pacjenci o jaśniejszym kolorze skóry cierpią cztery razy bardziej z powodu właściwości psoralenów generujących czerniaka niż osoby o ciemniejszej skórze. Krótkoterminowe skutki uboczne Psoralenu obejmują nudności, wymioty, rumień, świąd, suchość skóry, ból skóry z powodu fototoksycznego uszkodzenia nerwu skórnego i mogą powodować złośliwe zmiany skórne i genitalne skóry.
Dodatkowym zastosowaniem zoptymalizowanych psoralenów jest inaktywacja patogenów w produktach krwiopochodnych. Syntetyczny aminopsoralen, amotosalen HCl, został opracowany do inaktywacji patogenów zakaźnych (bakterie, wirusy, pierwotniaki) w płytkowych i osoczowych składnikach krwi przygotowanych do wspomagania transfuzji pacjentów. Przed zastosowaniem klinicznym zbadano płytki krwi traktowane amotosalenem i stwierdzono, że nie są rakotwórcze przy użyciu ustalonego mysiego modelu z nokautem p53 . Technologia jest obecnie rutynowo stosowana w niektórych europejskich ośrodkach krwi, a niedawno została zatwierdzona w USA.
Chemia
Psoralen interkaluje do podwójnej helisy DNA, gdzie jest idealnie umiejscowiony, aby utworzyć jeden lub więcej adduktów z sąsiednimi zasadami pirymidynowymi, preferencyjnie tyminą, po wzbudzeniu fotonem ultrafioletowym.
Do wyznaczenia stałych wiązania dla oddziaływań psoralen-DNA zastosowano kilka metod fizykochemicznych. Klasycznie, dwie komory z psoralenem i roztworem buforowanego DNA są rozdzielone przez półprzepuszczalną membranę ; powinowactwo psoralenu do DNA jest bezpośrednio związane ze stężeniem psoralenu w komorze DNA po stanie równowagi. Rozpuszczalność w wodzie jest ważna z dwóch powodów: farmakokinetyki związanej z rozpuszczalnością leku we krwi oraz konieczności stosowania rozpuszczalników organicznych (np. DMSO ). Psoraleny można również aktywować przez napromieniowanie światłem UV o długich falach. Podczas gdy światło z zakresu UVA jest standardem klinicznym, badania, które wykazały, że promieniowanie UVB jest bardziej skuteczne w tworzeniu fotoadduktów, sugeruje, że jego zastosowanie może prowadzić do wyższej skuteczności i skrócenia czasu leczenia.
Fotochemicznie reaktywne miejsca w psoralenach to alkenowe wiązania podwójne węgiel-węgiel w pierścieniu furanowym (pierścień pięcioczłonowy) i pierścieniu pironowym (pierścień sześcioczłonowy). Gdy odpowiednio interkaluje się w sąsiedztwie zasady pirymidynowej, czterocentrowa reakcja fotocykloaddycji może prowadzić do utworzenia jednego z dwóch monoadduktów typu cyklobutylu. Zwykle monoaddukty po stronie furanu tworzą się w większej proporcji. Monoaddukt furanowy może absorbować drugi foton UVA, prowadząc do drugiej czterośrodkowej fotocykloaddycji na końcu pironowym cząsteczki, a tym samym do tworzenia diadduktu lub wiązania poprzecznego. Monoaddukty pironowe nie absorbują w zakresie UVA, a zatem nie mogą tworzyć wiązań poprzecznych przy dalszym napromienianiu UVA.
Inną ważną cechą tej klasy związków jest ich zdolność do generowania tlenu singletowego , chociaż proces ten bezpośrednio konkuruje z tworzeniem adduktów i może być alternatywną ścieżką rozpraszania energii stanu wzbudzonego.
Badania nad psoralenami historycznie koncentrowały się na interakcjach z DNA i RNA (w szczególności na formowaniu ICL). Wykazano jednak, że psoralen blokuje również sygnalizację receptora ErbB2, który jest nadeksprymowany w niektórych agresywnych typach raka piersi. Syntetyczna pochodna bergaptenu , 5-(4-fenoksybutoksy)psoralen, jest obiecująca jako środek immunosupresyjny poprzez hamowanie specyficznego kanału potasowego . Jego struktura zapobiega interkalacji do DNA i bardzo słabo wytwarza tlen singletowy, znacznie zmniejszając niepożądaną toksyczność i mutagenność in vivo . Ma to wpływ na leczenie różnych chorób autoimmunologicznych (np. stwardnienia rozsianego , cukrzycy typu 1 i reumatoidalnego zapalenia stawów ). Chociaż modyfikacja powierzchni komórki i blokowanie kanałów jonowych to dwa nowo odkryte mechanizmy działania, wiele badań pozostaje do zrobienia.
Struktura
Większość furanokumaryn można uznać za pochodne psoralenu lub angelicyny . Psoralen i jego pochodne często określa się mianem liniowych furanokumaryn , tak zwanych, ponieważ wykazują liniową budowę chemiczną. Ważne liniowe furanokumaryny obejmują ksantotoksynę (zwaną również metoksalenem ), bergapten , imperatorynę i nodakenetynę .
Strukturę psoralenu pierwotnie wywnioskowano, identyfikując produkty jego reakcji degradacji. Wykazuje normalne reakcje laktonu kumaryny, takie jak otwieranie pierścienia zasadą z wytworzeniem kwasu kumarynowego lub pochodnej kwasu kumarynowego . Nadmanganian potasu powoduje utlenianie pierścienia furanowego, podczas gdy inne metody utleniania wytwarzają kwas furano-2,3-karboksylowy.
Synteza
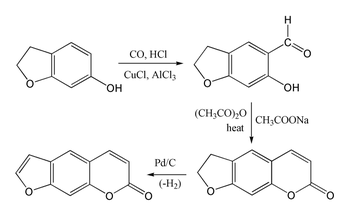
Psoralen jest trudny do zsyntetyzowania, ponieważ umbelliferon podlega podstawieniu w pozycji 8, a nie w pożądanej pozycji 6. Benzofuran reaguje preferencyjnie w pierścieniu furanowym , a nie w pierścieniu benzenowym . Jednak 7-hydroksy pochodna 2,3-dihydrobenzofuranu (zwana także kumaranem) ulega podstawieniu w pożądanej pozycji 6, umożliwiając następującą syntezę układu kumaryny przez reakcję Gattermanna-Kocha, a następnie kondensację Perkina z użyciem bezwodnika octowego . Synteza jest następnie zakończona przez odwodornienie pięcioczłonowego pierścienia w celu wytworzenia pierścienia furanowego.
Biosynteza
Psoralen pochodzi z kumaryn na szlaku szikimowym ; jego biosyntezę przedstawiono na poniższym rysunku. Pierścień aromatyczny w 6 jest aktywowany w pozycjach orto do grupy hydroksylowej i jest alkilowany przez 5, środek alkilujący . Grupa dimetyloallilowa w 7 następnie ulega cyklizacji z grupą fenolową do 8. Ta transformacja jest katalizowana przez monooksygenazę zależną od cytochromu P-45017 (psoralen 5-monooksygenaza) i kofaktory ( NADPH ) i tlen cząsteczkowy.
Na poniższym rysunku przedstawiono ścieżkę biosyntezy, w której powstaje psoralen. Drugi enzym monooksygenazy zależnej od P-450 ( syntaza psoralenu ) następnie odcina 10 (w postaci 11) od 8 do 1. Ten szlak nie obejmuje żadnego hydroksylowanego produktu pośredniego i postuluje się, że odcięcie jest inicjowane przez reakcję radykalną .
Źródła roślinne
Ficus carica (fig.) jest prawdopodobnie najliczniejszym źródłem psoralenów. Występują również w niewielkich ilościach w Ammi visnaga (bisnaga), Pastinaca sativa (pasternak), Petroselinum crispum ( pietruszka ), Levisticum officinale (lubczyk), Foeniculum vulgare (owoce tj. nasiona kopru włoskiego), Daucus carota (marchew), Psoralea Corylifolia (babchi), Apium graveolens (seler), olejek bergamotowy ( bergapten , bergamottyna ).
Naprawa adduktów psoralenowego DNA
Traktowanie PUVA wytwarza zarówno wiązania krzyżowe między nićmi DNA (ICL), jak i monoaddukty. ICL wprowadzone przez psoralen są wysoce genotoksyczne dla aktywnie replikujących się komórek. Połączenie kowalencyjne utrudnia progresję widełek replikacyjnych . Dlatego przed wznowieniem replikacji wymagane jest odłączenie ICL. Początkowe etapy naprawy zwykle obejmują nacięcia w jednej macierzystej nici po obu stronach usieciowania. Następnie naprawa zmiany może nastąpić w wyniku dokładnego lub niedokładnego procesu.
Dokładnym procesem naprawy wiązań poprzecznych jest naprawa homologiczna (HRR). Wiąże się to z zastąpieniem uszkodzonych informacji nienaruszonymi informacjami z innego homologicznego chromosomu w tej samej komórce. Komórki Escherichia coli z niedoborem HRR są bardzo wrażliwe na PUVA w porównaniu z komórkami typu dzikiego. HRR wydaje się być skuteczny. W E. coli , nawet jeśli jedno lub dwa nienaprawione wiązania usieciowane są wystarczające do dezaktywacji komórki, komórka typu dzikiego może naprawić, a zatem odzyskać od 53 do 71 wiązań usieciowanych psoralenów. W drożdżach Saccharomyces cerevisiae HRR jest głównym szlakiem do dokładnego usuwania wiązań sieciujących psoralen. W drożdżach typu dzikiego zdarzenia rekombinacji związane z usuwaniem wiązania krzyżowego przez HRR są głównie zdarzeniami konwersji genów niekrzyżowanych . Sieciowe wiązania psoralenowe w DNA wirusa również wydają się być usuwane przez rekombinacyjny proces naprawy, jak to ma miejsce w komórkach zakażonych wirusem SV40 oraz w komórkach zakażonych wirusem opryszczki pospolitej.
Wydaje się, że jeden z niedokładnych sposobów naprawy usieciowanych psoralenów wykorzystuje polimerazę DNA do wypełnienia luki utworzonej w nici z dwoma nacięciami. Proces ten jest niedokładny, ponieważ komplementarna nienacięta nić nadal zachowuje część wiązania usieciowanego, a zatem nie może służyć jako odpowiednia matryca do dokładnej syntezy naprawczej. Niedokładna synteza naprawy może spowodować mutację . Monoaddukty psoralenu w matrycowej nici DNA mogą również powodować niedokładne obejście replikacji ( synteza translekcji ), co może prowadzić do mutacji. W fagu T4 stwierdzono , że wzrost mutacji obserwowany po leczeniu PUVA odzwierciedla syntezę translezji przez polimerazę DNA typu dzikiego, prawdopodobnie z powodu niedoskonałej zdolności odczytu dowodu.
Analiza struktur kwasów nukleinowych
Psoraleny mogą odwracalnie sieciować podwójne helisy kwasów nukleinowych i dlatego są szeroko stosowane do analizy oddziaływań i struktur zarówno DNA, jak i RNA.
Bibliografia
Dalsza lektura
- Dziekan FM (1963). Naturalnie występujące związki pierścienia tlenowego . Londyn: Butterworths.
- Indeks Merck (wyd. 7). Rahway NJ: Merck. 1960.