Guanidyna - Guanidine
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
Guanidyna |
|||
| Inne nazwy
Iminometanodiamina
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| 506044 | |||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| DrugBank | |||
| Karta informacyjna ECHA |
100.003.656 |
||
| Numer WE | |||
| 100679 | |||
| Siatka | Guanidyna | ||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C H 5 N 3 | |||
| Masa cząsteczkowa | 59,072 g·mol -1 | ||
| Temperatura topnienia | 50 ° C (122 ° F; 323 K) | ||
| log P | -1,251 | ||
| Kwas sprzężony | guanidynia | ||
| Termochemia | |||
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
−57 – −55 kJ mol −1 | ||
|
Standardowa entalpia
spalania (Δ c H ⦵ 298 ) |
-1,0511 – -1,0531 MJ mol -1 | ||
| Farmakologia | |||
| Farmakokinetyka : | |||
| 7–8 godzin | |||
| Zagrożenia | |||
| Dawka lub stężenie śmiertelne (LD, LC): | |||
|
LD 50 ( mediana dawki )
|
475 mg/kg (doustnie, szczur) | ||
| Związki pokrewne | |||
|
Związki pokrewne
|
|||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
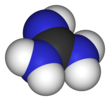
Guanidyny jest związek o wzorze HNC (NH 2 ) 2 . Jest to bezbarwne ciało stałe, które rozpuszcza się w rozpuszczalnikach polarnych. Stanowi mocną bazę, która wykorzystywana jest w produkcji tworzyw sztucznych i materiałów wybuchowych . Występuje w moczu jako normalny produkt metabolizmu białek . Ugrupowanie guanidyny pojawia się również w większych cząsteczkach organicznych, w tym w łańcuchu bocznym argininy .
Struktura
Guanidynę można uznać za azotowy analog kwasu węglowego . Oznacza to, że grupa C = O w kwasie węglowym jest zastąpiona grupą C = NH, a każdy OH jest zastąpiony przez NH
2Grupa. Izobutylen można postrzegać jako analog węgla w bardzo podobny sposób. Szczegółowa analiza krystalograficzna guanidyny została wyjaśniona 148 lat po jej pierwszej syntezie, pomimo prostoty cząsteczki. W 2013 r. za pomocą dyfrakcji neutronów monokrystalicznych precyzyjnie wyznaczono położenie atomów wodoru i ich parametry przemieszczenia.
Produkcja
Guanidynę można uzyskać ze źródeł naturalnych, najpierw wyizolowaną przez Adolpha Streckera poprzez rozkład guaniny . Została po raz pierwszy zsyntetyzowana w 1861 roku przez oksydacyjną degradację aromatycznego produktu naturalnego, guaniny , wyizolowanego z peruwiańskiego guana .
Laboratoryjną metodą wytwarzania guanidyny jest łagodny (180-190 °C) rozkład termiczny suchego tiocyjanianu amonu w warunkach bezwodnych:
Droga komercyjna obejmuje dwuetapowy proces rozpoczynający się od reakcji dicyjanodiamidu z solami amonowymi . Za pośrednictwem biguanidyny w tym etapie amonolizy otrzymuje się sole kationu guanidyniowego (patrz poniżej). W drugim etapie sól traktuje się zasadą, taką jak metanolan sodu .
Chemia
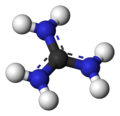
Kation guanidyniowy
Z AP K b 0,4, guanidyna jest mocną zasadą. Większość pochodnych guanidyny to w rzeczywistości sole zawierające sprzężony kwas.
Skoniugowany kwas nazywa się guanidyny kation , ( C (NH
2)+
3). Ten płaski, symetryczny jon składa się z trzech grup aminowych, z których każda jest związana z centralnym atomem węgla wiązaniem kowalencyjnym rzędu 4/3. Jest to wysoce stabilny kation +1 w roztworze wodnym dzięki wydajnej stabilizacji rezonansowej ładunku i wydajnej solwatacji przez cząsteczki wody. W rezultacie, jego P K aH wynosi 13,6 oznacza, że guanidyny jest bardzo mocne zasady, w wodzie; w wodzie obojętnej istnieje prawie wyłącznie jako guanidynia.
Testowanie na guanidynę
Guanidynę można selektywnie wykryć przy użyciu kwasu 1,2-naftochinono-4-sulfonowego sodu ( odczynnik Folina ) i zakwaszonego mocznika.
Zastosowania
Przemysł
Główną solą o znaczeniu handlowym jest azotan [C( NH
2) 3 ] NIE
3. Wykorzystywany jest jako propelent, np. w poduszkach powietrznych .
Biochemia
Guanidyna istnieje w postaci protonowanej, podobnie jak guanidynia, w roztworze o fizjologicznym pH.
Chlorek guanidyny (znany również jako chlorowodorek guanidyny) ma właściwości chaotropowe i służy do denaturacji białek. Wiadomo, że chlorek guanidyny denaturuje białka z liniową zależnością między stężeniem a swobodną energią rozwijania. W roztworach wodnych zawierających 6 M chlorek guanidyny prawie wszystkie białka tracą całą swoją strukturę drugorzędową i stają się losowo zwiniętymi łańcuchami peptydowymi. Tiocyjanian guanidyny jest również stosowany ze względu na jego działanie denaturujące na różne próbki biologiczne.
Chlorek guanidyny jest stosowany jako adiuwant w leczeniu zatrucia jadem kiełbasianym , wprowadzonym w 1968 roku, ale obecnie jego rola jest kontrowersyjna – ponieważ u części pacjentów nie nastąpiła poprawa po podaniu tego leku.
Inny
Wodorotlenek guanidyny jest aktywnym składnikiem niektórych nieługowych preparatów do włosów .
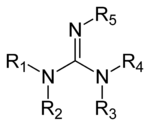
Pochodne guanidyny
Guanidyny to grupa związków organicznych o wspólnej grupie funkcyjnej o strukturze ogólnej (R
1R
2N)(R
3R
4N)C=N−R
5. Centralnym wiązaniem w tej grupie jest imina , a grupa ta jest strukturalnie powiązana z amidynami i mocznikami. Przykładami guanidyny są arginina , triazabicyklodecen , saksytoksyna i kreatyna .
Galegina to izoamyleno- guanidyna.