Wiązanie halogenowe - Halogen bond
Wiązanie chlorowiec występuje wtedy, gdy istnieje dowód z oddziaływaniem przyciągania pomiędzy netto z elektrofilowym regionu związanego z halogenu atom, w postaci cząsteczkowej i nukleofilowego obszaru w drugiej, albo same, jednostki molekularnej.
Klejenie
Porównanie wiązania wodorowego i halogenowego:
- Wiązanie wodorowe
- Wiązanie halogenowe
W obu przypadkach A (akceptor wiązań wodorowych/halogenowych) jest atomem, grupą lub cząsteczką, która przekazuje elektrony ubogim w elektrony gatunkom HD lub XD (odpowiednio donorom wiązań wodorowych lub halogenowych). H jest atomem wodoru zaangażowanym w wiązanie wodorowe, a X jest atomem halogenu zaangażowanym w wiązanie halogenowe. Zauważ, że donor wiązania halogenowego przyjmuje elektrony, podczas gdy akceptor wiązania halogenowego oddaje elektrony.
Można łatwo wyznaczyć równoległą zależność między wiązaniem halogenowym a wiązaniem wodorowym (HB). W obu typach wiązania An donor elektronów / elektronów akceptor związek istnieje. Różnica między nimi polega na tym, jakie gatunki mogą działać jako donor elektronów/akceptor elektronów. W wiązaniach wodorowych atom wodoru działa jako akceptor elektronów i tworzy interakcję niekowalencyjną, przyjmując gęstość elektronów z miejsca bogatego w elektrony (donor elektronów). W wiązaniu halogenowym akceptorem elektronów jest atom halogenu. Jednocześnie normalne wiązanie kowalencyjne między H lub X i D słabnie, więc gęstość elektronów na H lub X wydaje się być zmniejszona. Transfery gęstości elektronowej powodują penetrację objętości van der Waalsa .
Halogeny uczestniczące w wiązaniu halogenów obejmują: jod (I), brom (Br), chlor (Cl), a czasem fluor (F). Wszystkie cztery halogeny mogą działać jako donory XB (co dowiodły dane teoretyczne i doświadczalne) i podążają za ogólnym trendem: F < Cl < Br < I, przy czym jod zwykle tworzy najsilniejsze interakcje.
Dihalogens (I 2 , Br 2 , itd.) Mają tendencję do tworzenia silnych wiązań halogenu. Siła i skuteczność chloru i fluoru w tworzeniu XB zależy od charakteru dawcy XB. Jeśli halogen jest związany z ugrupowaniem elektroujemnym (wycofującym elektron), jest bardziej prawdopodobne, że utworzy silniejsze wiązania halogenowe.
Na przykład jodoperfluoroalkany są dobrze zaprojektowane do inżynierii kryształów XB . Ponadto jest to również powód, dla którego F 2 może działać jako silny donor XB, ale fluorowęglowodory są słabymi donorami XB, ponieważ grupa alkilowa połączona z fluorem nie jest elektroujemna. Ponadto zasada Lewisa (akceptor XB) ma tendencję do bycia elektroujemną, a aniony są lepszymi akceptorami XB niż cząsteczki obojętne.
Wiązania halogenowe są silnymi, specyficznymi i kierunkowymi oddziaływaniami, które dają początek dobrze zdefiniowanym strukturom. Siły wiązania halogenowego wahają się od 5-180 kJ/mol. Siła XB pozwala mu konkurować z nieco słabszymi HB. Wiązania halogenowe mają tendencję do tworzenia się pod kątem 180°, co wykazano w badaniach Odda Hassela z bromem i 1,4-dioksanem w 1954 roku. Innym czynnikiem wpływającym na siłę wiązania halogenowego jest niewielka odległość między halogenami (kwas Lewisa, XB dawcy) i zasady Lewisa (akceptor XB). Atrakcyjny charakter wiązań halogenowych powoduje, że odległość między donorem i akceptorem jest mniejsza niż suma promieni van der Waalsa. Oddziaływanie XB staje się silniejsze, gdy zmniejsza się odległość między halogenem a zasadą Lewisa.
Historia
W 1814 roku Jean-Jacques Colin opisał powstawanie cieczy — o metalicznym połysku — kiedy zmieszał suchy gazowy amoniak i suchy jod. Dokładny skład powstałego kompleksu I 2 ···NH 3 został ustalony pięćdziesiąt lat później przez Fredericka Guthrie. W swoim eksperymencie dodał I 2 do wodnego amoniaku. Prawdziwa natura interakcji molekularnych została prawdopodobnie po raz pierwszy zrozumiana dopiero pół wieku temu po przełomowych odkryciach Roberta Mullikena dotyczących oddziaływań z przeniesieniem ładunku i ich szczegółowym opisie przez Odda Hassela.
W latach pięćdziesiątych Robert S. Mulliken opracował szczegółową teorię kompleksów donor-akceptor elektronów, klasyfikując je jako zewnętrzne lub wewnętrzne kompleksy. Kompleksy zewnętrzne to te, w których oddziaływania międzycząsteczkowe między donorem elektronów i akceptorem były słabe i miały bardzo mały transfer ładunku. Kompleksy wewnętrzne mają rozległą redystrybucję ładunku. Teoria Mullikena została wykorzystana do opisania mechanizmu powstawania XB.
Mniej więcej w tym samym czasie, w którym Mulliken rozwinął swoją teorię, zaczęły pojawiać się badania krystalograficzne Hassela, które stały się punktem zwrotnym w zrozumieniu formacji XB i jej cech.
Pierwsze badanie krystalografii rentgenowskiej przeprowadzone przez grupę Hassela miało miejsce w 1954 roku. W eksperymencie jego grupie udało się pokazać strukturę 1,4-dioksanianu bromu przy użyciu technik dyfrakcji rentgenowskiej . Eksperyment ujawnił, że pomiędzy atomami tlenu dioksanu i bromu występuje krótkie oddziaływanie międzycząsteczkowe. Odległość O-Br w krysztale zmierzono przy 2,71 Å, co wskazuje na silne oddziaływanie między atomami bromu i tlenu. Ponadto odległość ta jest mniejsza niż suma promieni van der Waalsa tlenu i bromu (3,35 Å). Kąt pomiędzy wiązaniem O-Br i Br-Br wynosi około 180°. Był to pierwszy dowód typowych cech występujących w tworzeniu wiązań halogenowych i doprowadził Hassela do wniosku, że atomy halogenu są bezpośrednio połączone z dawcą pary elektronów w kierunku wiązania, który pokrywa się z osiami orbitali wolnych par w dawcy pary elektronów cząsteczka.
W 1969 Hassel otrzymał Nagrodę Nobla w dziedzinie chemii za wybitne odkrycie, że halogeny mogą działać jako elektrofilowe, akceptory elektronów i samoorganizują się w wysoce kierunkowo zorganizowane krystaliczne kompleksy z przeniesieniem ładunku w obecności donorów elektronów. Wczesny przegląd dotyczący donorów-akceptorów elektronów przedstawił Bent w 1968 r. Użycie terminu „wiązanie halogenowe” nie zostało wdrożone do 1978 r. przez Dumasa i współpracowników, którzy badali kompleksy CCl 4 , CBr 4 , SiCl 4 i SiBr 4 . z tetrahydrofuranem , tetrahydropiranem , pirydyną , anizolem i eterem di-n-butylowym w rozpuszczalnikach organicznych.
Jednak dopiero w połowie lat 90. zaczęto intensywnie badać naturę i zastosowania wiązania halogenowego. Systematyczne i szeroko zakrojone prace Legona i współpracowników, którzy badali szeroką gamę adduktów wiązanych wiązaniem halogenowym powstających w fazie gazowej za pomocą spektroskopii mikrofalowej, zwróciły uwagę na podobieństwa między wiązaniami halogenowymi i lepiej znanymi oddziaływaniami wiązaniami wodorowymi. Obliczenia obliczeniowe Politzera i Murraya były szczególnie istotne, ponieważ ujawniły, że wysoka kierunkowość wiązania halogenowego jest wynikiem anizotropowego rozkładu gęstości elektronowej wokół jądra halogenowego i utorowały drogę do definicji „dziury σ”.
Obecnie XB jest wykorzystywany do szeregu zastosowań funkcjonalnych, np. inżynierii kryształów, chemii supramolekularnej, nauk o polimerach, ciekłych kryształów, materiałów przewodzących i chemii medycznej.
Aplikacje
Inżynieria kryształów
Inżynieria kryształów to rozwijający się obszar badawczy, który łączy chemię ciała stałego i supramolekularną. Ta wyjątkowa dziedzina ma charakter interdyscyplinarny i łączy tradycyjne dyscypliny, takie jak krystalografia , chemia organiczna i chemia nieorganiczna . W 1971 Schmidt po raz pierwszy założył tę dziedzinę, publikując publikację na temat fotodimeryzacji w stanie stałym. Nowsza definicja określa inżynierię krystaliczną jako wykorzystanie oddziaływań międzycząsteczkowych do krystalizacji i opracowywania nowych substancji o różnych pożądanych właściwościach fizykochemicznych. Przed odkryciem wiązań halogenowych podejście do inżynierii krystalicznej obejmowało wykorzystanie wiązań wodorowych , chemii koordynacyjnej i interakcji międzyjonowych do opracowania materiałów ciekłokrystalicznych i stałych-krystalicznych. Ponadto wiązanie halogenowe jest wykorzystywane do organizowania rodnikowych soli kationowych, wytwarzania przewodników molekularnych i tworzenia konstrukcji ciekłokrystalicznych. Od czasu odkrycia wiązania halogenowego istnieją nowe zespoły molekularne. Ze względu na wyjątkową chemiczną naturę wiązania halogenowego, to oddziaływanie międzycząsteczkowe służy jako dodatkowe narzędzie do rozwoju inżynierii krystalicznej.
Po raz pierwszy doniesiono o zastosowaniu wiązania halogenowego w tworzeniu ciekłych kryształów przez H. Loc Nguyen. W celu wytworzenia ciekłych kryształów zastosowano alkoksystilbazole i pentafluorojodobenzen. Wcześniejsze badania przeprowadzone przez Metrangolo i Resnati wykazały przydatność pentafluorojodobenzenu w strukturach ciała stałego. Różne alkoksystilbazole są wykorzystywane do optyki nieliniowej i metalomezogenów. Korzystając z innego odkrycia Resnati (np. silnie tworzą się kompleksy N−I), grupa zaprojektowała kompleksy z wiązaniami halogenowymi z jodopentafluorobenzenem i 4-alkoksystilbazolami. Krystalografia rentgenowska wykazała odległość N−I 2,811(4) Å, a kąt wiązania 168,4°. Podobne odległości N−I zmierzono w stałych proszkach. Odkryta odległość N−I jest krótsza niż suma promieni Van Der Waalsa dla azotu i jodu (3,53 Å). Monokrystaliczna struktura molekuł wskazywała na brak oddziaływań kwadrupolowych. Stwierdzono, że kompleksy na rysunku 4 są ciekłokrystaliczne.
Aby przetestować pojęcie udziału polaryzowalności w sile wiązania halogenowego, jako zasadę Lewisa zastosowano bromopentafluorobenzen. W konsekwencji nie uzyskano weryfikacji tworzenia kompleksu wiązania halogenowego. To odkrycie dostarcza więcej dowodów na zależność wiązania halogenowego od polaryzowalności atomowej. Wykorzystując podobne struktury donora-akceptora, autorzy wykazali, że siła wiązania halogenu w stanie ciekłokrystalicznym jest porównywalna z mezogenami związanymi wiązaniami wodorowymi.
Przygotowanie poli(dijododiacetylenu)
Zastosowania wykorzystujące właściwości polimerów sprzężonych powstały w wyniku prac Heegera, McDiaramida i Shirakawy, w których odkryto, że poliacetylen jest materiałem przewodzącym, choć trudnym w obróbce. Od tego czasu prowadzono prace mające na celu naśladowanie szkieletu tego sprzężonego polimeru (np. poli(p-fenylenevinylen)). Polimery sprzężone mają wiele praktycznych zastosowań i są wykorzystywane w urządzeniach takich jak ogniwa fotowoltaiczne , organiczne diody elektroluminescencyjne , tranzystory polowe i czujniki chemiczne . Goroff i in. przygotowany uporządkowany poli(dijododiacetylen) (PIDA) poprzez wstępne ułożenie monomeru (2) z rusztowaniem wiązania halogenowego. PIDA jest doskonałym prekursorem innych sprzężonych polimerów, ponieważ jod może być łatwo przekształcany. Na przykład rozszczepienie C−I jest możliwe dzięki redukcji elektrochemicznej .
Struktury krystaliczne monomeru (2) są nieuporządkowanymi materiałami o różnym składzie i łączności. Żywiciele (3–7) badano pod kątem ich upakowania molekularnego, głównie poprzez badanie kokryształów monomeru (2) i odpowiedniego gospodarza. Zarówno (3), jak i (4) wstępnie zorganizowany monomer (2), ale steryczne stłoczenie wokół jodów uniemożliwiło udaną topologiczną polimeryzację monomeru. Gospodarze (5–7) wykorzystują wiązania wodorowe i halogenowe, aby utrzymać monomer (2) w optymalnej odległości od siebie, aby ułatwić polimeryzację.
W rzeczywistości, gdy zastosowano gospodarza 7, polimeryzacja zachodziła spontanicznie po wyodrębnieniu kokryształów. Struktury krystaliczne pokazują, że wszystkie nici polimeru są równoległe do sieci wiązań wodorowych, a nitryle gospodarza są połączone wiązaniami halogenowymi z atomami jodu. Połowa atomów jodu w (1) w krysztale jest w bliskim kontakcie z atomami tlenu oksaloamidu. Atomy tlenu gospodarza 7 działają jako akceptory wiązań wodorowych i halogenowych.

Struktury porowate
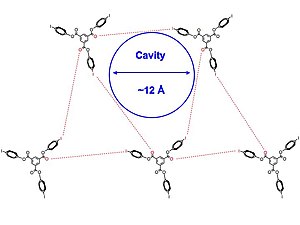
Struktury porowate mają różnorodne zastosowania. Wielu chemików i naukowców zajmujących się materiałami pracuje nad udoskonaleniem struktur metaloorganicznych (MOF) do przechowywania wodoru do wykorzystania w samochodach. Te wysoce zorganizowane krystaliczne kompleksy inkluzyjne mają potencjalne zastosowania w urządzeniach do katalizy i separacji molekularnej. Organizacja molekularna jest często kontrolowana przez siły międzycząsteczkowe, takie jak wiązania wodorowe . Jednak wykorzystanie wiązania wodorowego często ogranicza zakres dostępnych rozmiarów porów ze względu na ścisłe upakowanie.
Pigge i in. wykorzystali oddziaływania wiązania halogenowego między aminami , heterocyklami azotu , grupami karbonylowymi i innymi halogenkami organicznymi do budowy ich porowatych struktur. Jest to istotne, ponieważ organiczne sieci krystaliczne, w których pośredniczą wiązania halogenowe, oddziaływanie znacznie słabsze niż wiązanie wodorowe, są rzadkie.
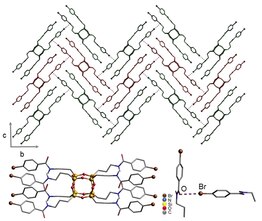
Struktury krystaliczne 1 i 2 [poniżej] otrzymano w różnych rozpuszczalnikach , takich jak dichlorometan , pirydyna i benzen . Autorzy zauważają, że porowate kompleksy inkluzyjne wydają się być częściowo pośredniczone przez bezprecedensowe oddziaływania I-π oraz przez wiązanie halogenowe między grupami jodowymi i karbonylowymi . Struktura krystaliczna [pokazana poniżej] łączy się w trójkątny układ, a cząsteczki 2 są w przybliżeniu symetryczne. Dodatkowo, wszystkie zestawy oddziaływań wiązania halogenowego nie są identyczne, a wszystkie oddziaływania międzycząsteczkowe pomiędzy halogenem i akceptorem wiązania halogenowego nieznacznie przekraczają sumę promienia Van der Waalsa , co oznacza nieco słabsze wiązanie halogenowe, co prowadzi do większej elastyczności w struktura. Warstwy 2D układają się równolegle do siebie, tworząc kanały wypełnione rozpuszczalnikiem.
W tworzeniu struktur heksagonalnych obserwuje się również oddziaływania rozpuszczalników, zwłaszcza w pirydynie i chloroformie . Początkowo kryształy tworzące te roztwory tworzą struktury kanałowe. Z biegiem czasu, nowe, podobne do igieł, pozbawione solwatów struktury, są upakowane ciaśniej razem, a te igły są w rzeczywistości termodynamicznie preferowanym kryształem. Autorzy mają nadzieję wykorzystać te informacje do lepszego zrozumienia komplementarnej natury wiązań wodorowych i halogenowych w celu zaprojektowania małych cząsteczek przewidujących struktury.
Wiązanie halogenowe w makrocząsteczkach biologicznych
Przez pewien czas pomijano znaczenie wiązania halogenowego z biologiczną strukturą makrocząsteczkową. W oparciu o struktury monokryształów w banku danych białek (PDB) (wersja z lipca 2004 r.), badanie przeprowadzone przez Auffingera i innych na strukturach monokryształów o rozdzielczości 3 Å lub lepszej wprowadzonych do PDB ujawniło, że ponad 100 wiązań halogenowych znaleziono w sześciu struktury kwasów nukleinowych na bazie halogenów i sześćdziesiąt sześć kompleksów białko-substrat do oddziaływań halogen-tlen. Chociaż nie tak częste jak oddziaływania halogen-tlen, zidentyfikowano również kontakty halogen-azot i halogen-siarka. Te odkrycia naukowe stanowią wyjątkową podstawę do wyjaśnienia roli wiązania halogenowego w układach biologicznych.
Na poziomie biomolekularnym wiązanie halogenowe jest ważne dla specyficzności substratu, wiązania i fałdowania molekularnego. W przypadku oddziaływań białko-ligand, najpowszechniejsze wiązania z przeniesieniem ładunku z polaryzowalnymi halogenami obejmują szkieletowe karbonylki i/lub grupy hydroksylowe i karboksylanowe reszt aminokwasowych. Zazwyczaj w kompleksach DNA i białko-ligand odległość wiązania między atomami donora zasady Lewisa (np. O, S, N) i kwasu Lewisa (halogen) jest krótsza niż suma ich promienia Van der Waalsa. W zależności od środowiska strukturalnego i chemicznego oddziaływania wiązania halogenowego mogą być słabe lub silne. W przypadku niektórych kompleksów białko-ligand wiązania halogenowe są energetycznie i geometrycznie porównywalne z wiązaniami wodorowymi, jeśli kierunek donor-akceptor pozostaje spójny. Wykazano, że to oddziaływanie międzycząsteczkowe jest stabilizujące i stanowi determinantę konformacyjną w strukturach białko-ligand i DNA.
Do rozpoznawania i wiązania molekularnego istotne może być wiązanie halogenowe. Przykładem tego twierdzenia w projektowaniu leków jest specyficzność substratowa dla wiązania IDD594 z ludzką reduktazą aldozową . EI Howard podał najlepszą rozdzielczość dla tego monomerycznego enzymu. Ta biologiczna makrocząsteczka składa się z 316 reszt i redukuje aldozy, kortykosteroidy i aldehydy. Uważa się, że D-sorbitol, produkt enzymatycznej konwersji D-glukozy, przyczynia się do dalszych skutków patologii cukrzycy. Dlatego hamowanie tego enzymu ma wartość terapeutyczną.
Inhibitory aldehydowe i karboksylanowe są skuteczne, ale toksyczne, ponieważ aktywność funkcjonalna reduktazy aldehydowej jest osłabiona. Wykazano, że inhibitory karboksylanowe i aldehydowe tworzą wiązania wodorowe z Trp 111, Tyr 48 i His 110. „Kieszonka specyficzności”, utworzona w wyniku wiązania inhibitora, składa się z Leu 300, Ala 299, Phe 122, Thr 113 i Trp 111. Aby inhibitory były skuteczne, zidentyfikowano kluczowe reszty interakcji jako Thr 113 i Trp 111. IDD 594 zaprojektowano tak, aby halogen zapewniał selektywność i był silny. Po związaniu związek ten wywołuje zmianę konformacyjną, która powoduje wystąpienie wiązania halogenowego między tlenem Thr i bromem inhibitora. Zmierzona odległość wiązania wynosiła 2,973(4) Å. To właśnie to wiązanie halogenowe O-Br przyczynia się do dużej siły działania tego inhibitora dla ludzkiej reduktazy aldozowej, a nie reduktazy aldehydowej .