Chlorek ołowiu (II) - Lead(II) chloride

|
|

|
|
| Nazwy | |
|---|---|
|
Nazwy IUPAC
Chlorek ołowiu (II)
Dichlorek ołowiu |
|
| Inne nazwy
Chlorek
ołowiu Cotunnite |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Karta informacyjna ECHA |
100.028.950 |
| Numer WE | |
|
PubChem CID
|
|
| UNII | |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| PbCl 2 | |
| Masa cząsteczkowa | 278,10 g / mol |
| Wygląd | białe bezwonne ciało stałe |
| Gęstość | 5,85 g / cm 3 |
| Temperatura topnienia | 501 ° C (934 ° F, 774 K) |
| Temperatura wrzenia | 950 ° C (1740 ° F; 1220 K) |
| 0,99 g / l (20 ° C) | |
|
Iloczyn rozpuszczalności ( K sp )
|
1,7 × 10-5 (20 ° C) |
| Rozpuszczalność | słabo rozpuszczalny w rozcieńczonym HCl , amoniaku ; nierozpuszczalny w alkoholu Rozpuszczalny w gorącej wodzie, a także w obecności wodorotlenku alkalicznego Rozpuszczalny w stężonym HCl (> 6 M) |
| -73,8 · 10-6 cm 3 / mol | |
|
Współczynnik załamania ( n D )
|
2.199 |
| Struktura | |
| Rombowa , oP12 | |
| Pnma, nr 62 | |
| Termochemia | |
|
Entropia trzonowa standardowa ( S |
135,98 J K −1 mol −1 |
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
-359,41 kJ / mol |
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych |
| Piktogramy GHS |
  
|
| Hasło ostrzegawcze GHS | Niebezpieczeństwo |
| H302 , H332 , H351 , H360 , H372 , H400 , H410 | |
| P201 , P261 , P273 , P304 + 340 , P308 + 313 , P312 , P391 | |
| NFPA 704 (ognisty diament) | |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LD Lo ( najniższa opublikowana )
|
1500 mg / kg (świnka morska, doustnie) |
| Związki pokrewne | |
|
Inne aniony
|
Fluorek ołowiu (II) Bromek ołowiu (II) Jodek ołowiu (II) |
|
Inne kationy
|
Chlorek ołowiu (IV) Chlorek cyny (II) Chlorek germanu (II) |
|
Związki pokrewne
|
Chlorek talu (I) Chlorek bizmutu |
| Strona z danymi uzupełniającymi | |
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe – ciecz – gaz |
| UV , IR , NMR , MS | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencje Infobox | |
Chlorek ołowiu (II) (PbCl 2 ) jest związkiem nieorganicznym, który w warunkach otoczenia jest białą substancją stałą. Jest słabo rozpuszczalny w wodzie. Chlorku ołowiu (II) jest jednym z najważniejszych ołowiu -na reagentów . Występuje również naturalnie w postaci mineralnego kotunitu .
Struktura i właściwości
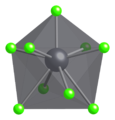
W stałym PbCl 2 każdy jon ołowiu jest koordynowany przez dziewięć jonów chlorkowych tworzących trójkątny trójkątny pryzmat - sześć leży na wierzchołkach trójkątnego pryzmatu, a trzy leżą poza środkami każdej prostokątnej powierzchni pryzmatu. 9 jonów chlorkowych nie jest w równej odległości od centralnego atomu ołowiu, 7 leży w 280–309 pm, a 2 przy 370 pm. PbCl 2 tworzy białe rombowe igły.
Ball-a-stick modelu stanowi część struktury krystalicznej z cotunnite
Geometria koordynacyjna Pb 2+
W fazie gazowej cząsteczki PbCl 2 mają wygiętą strukturę, przy czym kąt Cl – Pb – Cl wynosi 98 °, a odległość między wiązaniami Pb – Cl wynosi 2,44 Å. Takie PbCl 2 jest emitowane z silników spalinowych, że stosowanie chlorowodoru etylenu tetraetylku ołowiu dodatków celów przeciwstukowe.
PbCl 2 jest trudno rozpuszczalny w wodzie, iloczyn rozpuszczalności K sp = 1,7 x 10 -5 20 ° C. Jest to jedna z najczęściej tylko 5 nierozpuszczalnego w wodzie chlorków, drugi 4 jest chlorku talu (I) , chlorku srebra (AgCl) o k sp = 1,8 x 10 -10 , chlorek miedzi (I) (CuCl), w k sp = 1,72 × 10 −7 i chlorek rtęci (I) (Hg 2 Cl 2 ) z K sp = 1,3 × 10 −18 .
Występowanie
PbCl 2 występuje naturalnie w postaci mineralnego kotunitu . Jest bezbarwny, biały, żółty lub zielony o gęstości 5,3–5,8 g / cm 3 . Twardość w skali Mohsa wynosi 1,5–2. Struktura kryształu jest rombowa, dipiramidalna, a grupa punktowa wynosi 2 / m 2 / m 2 / m. Każdy Pb ma liczbę koordynacyjną równą 9. Cotunnite występuje w pobliżu wulkanów: Wezuwiusz , Włochy; Tarapacá , Chile; i Tolbachik , Rosja.
Synteza
Podwójne przemieszczenie / metatezy
Chlorek ołowiu (II) wytrąca się po dodaniu wodnych źródeł chlorków (HCl, NaCl, KCl) do związków ołowiu (II)
- Rozpuszczalne związki ołowiu
-
Azotan ołowiu (II)
- Pb (NO 3 ) 2 + 2 NaCl (aq) → PbCl 2 (s) + NaNO 3 (aq)
-
Octan ołowiu (II)
- Pb (CH 3 COO) 2 (aq) + HCl (aq) → PbCl 2 (s) + 2 CH 3 COOH
-
Azotan ołowiu (II)
- Nierozpuszczalne związki ołowiu
-
Węglan ołowiu (II)
- PbCO 3 + 2 HCl (aq) → PbCl 2 (s) + CO 2 (g) + H 2 O
-
Dwutlenek ołowiu
- PbO 2 (s) + 4 HCl → PbCl 2 (s) + Cl 2 + 2 H 2 O
-
Tlenek ołowiu (II)
- PbO (s) + 2 HCl → PbCl 2 (s) + H 2 O
-
Węglan ołowiu (II)
Bezpośrednia redukcja
PbCl 2 można wytworzyć przez redukcję chlorku miedzi (II) metalem ołowiu:
- Pb + CuCl 2 → PbCl 2 + Cu
Bezpośrednie chlorowanie
PbCl 2 powstaje również w wyniku działania chloru gazowego na ołów metaliczny:
- Pb + Cl 2 → PbCl 2
Reakcje
Dodatek jonów chlorkowych do zawiesiny PbCl 2 powoduje powstanie rozpuszczalnych jonów kompleksowych . W tych reakcjach dodatkowy chlorek (lub inne ligandy ) rozbijają mostki chlorkowe, które tworzą szkielet polimerowy stałego PbCl2 (ów) .
- PbCl 2 (s) + Cl - → [PbCl 3 ] - (aq)
- PbCl 2 (s) + 2 Cl - → [PbCl 4 ] 2− (aq)
PbCl 2 reaguje ze stopionym NaNO 2 dając PbO:
- PbCl 2 (l) + 3 NaNO 2 → PbO + NaNO 3 + 2 NO + 2 NaCl
PbCl 2 stosuje się w syntezie chlorku ołowiu (IV) (PbCl 4 ) Cl 2 przepuszczano przez nasycony roztwór PbCl 2 w wodnym NH 4 Cl formowania [NH 4 ] 2 [PbCl 6 ]. Ten ostatni poddaje się reakcji z zimnym stężonym kwasem siarkowym (H 2 SO 4 ), tworząc PbCl 4 w postaci oleju.
Chlorku ołowiu (II) jest głównym prekursorem w metaloorganiczne pochodne ołowiu, takich jak plumbocenes . Stosowane są zwykłe środki alkilujące, w tym odczynniki Grignarda i związki litoorganiczne:
- 2 PbCl 2 + 4 RLi → R 4 Pb + 4 LiCl + Pb
- 2 PbCl 2 + 4 RMgBr → R 4 Pb + Pb + 4 MgBrCl
- 3 PbCl 2 + 6 RMgBr → R 3 Pb-PbR 3 + Pb + 6 MgBrCl
W wyniku tych reakcji powstają pochodne, które są bardziej podobne do związków krzemoorganicznych, to znaczy, że Pb (II) ma tendencję do dysproporcjonowania po alkilowaniu.
PbCl 2 może być użyty do produkcji PbO 2 poprzez potraktowanie go podchlorynem sodu (NaClO), tworząc czerwono-brązowy osad PbO 2 .
Używa
- Stopiony PbCl 2 jest stosowany w syntezie tytanianu ołowiu i ceramiki tytanianu ołowiu baru w reakcjach wymiany kationów:
- x PbCl 2 (l) + BaTiO 3 (s) → Ba 1− x Pb x TiO 3 + x BaCl 2
- PbCl 2 jest używany do produkcji szkła przepuszczającego podczerwień oraz szkła ornamentowego zwanego szkłem aurenowym . Szkło Aurene ma opalizującą powierzchnię utworzoną przez spryskanie PbCl 2 i ponowne podgrzanie w kontrolowanych warunkach. W tym samym celu stosuje się chlorek cyny (SnCl 2 ).
- PB stosowane w służbie HCI chociaż PbCl 2 utworzona jest słabo rozpuszczalny w HCl. Dodatek 6–25% antymonu (Sb) zwiększa odporność na korozję.
- Zasadowy chlorek ołowiu, PbCl 2 · Pb (OH) 2 , jest znany jako biały ołów Pattinsona i jest używany jako pigment w białej farbie. Farba ołowiowa jest obecnie zakazana jako zagrożenie dla zdrowia w wielu krajach na mocy Konwencji o białym ołowiu (malowanie) z 1921 r .
- PbCl 2 jest półproduktem do rafinacji rudy bizmutu (Bi). Rudę zawierającą Bi, Pb i Zn najpierw traktuje się stopioną sodą kaustyczną w celu usunięcia śladów arsenu i telluru . Następnie następuje proces Parkesa, aby usunąć wszelkie obecne srebro i złoto. Ruda zawiera teraz Bi, Pb i Zn. Jest traktowany gazem Cl 2 w temperaturze 500 ° C. ZnCl 2 tworzy się jako pierwszy i jest usuwany. Następnie tworzy się PbCl 2 i jest usuwany, pozostawiając czysty Bi. BiCl 3 byłby trwały.
Toksyczność
Podobnie jak inne rozpuszczalne związki ołowiu, ekspozycja na PbCl 2 może spowodować zatrucie ołowiem .