Tlenek rutenu(IV) - Ruthenium(IV) oxide
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
Tlenek rutenu(IV)
|
|
| Inne nazwy
Dwutlenek rutenu
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| Karta informacyjna ECHA |
100.031.660 |
| Numer WE | |
|
Identyfikator klienta PubChem
|
|
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| RuO 2 | |
| Masa cząsteczkowa | 133,0688 g/mol |
| Wygląd zewnętrzny | niebiesko-czarne ciało stałe |
| Gęstość | 6,97 g / cm 3 |
| Temperatura wrzenia | 1200 ° C (2190 ° F; 1470 K) sublimuje |
| nierozpuszczalny | |
| + 162,0 x 10 -6 cm 3 / mol | |
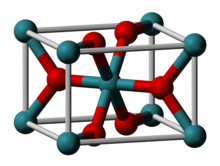
| Struktura | |
| Rutyl ( czterokąt ), tP6 | |
| P 4 2 / mnm , nr 136 | |
| Oktaedryczny (Ru IV ); trygonalny planarny (O 2- ) | |
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | Zobacz: strona danych |
| Temperatura zapłonu | Nie palne |
| Związki pokrewne | |
|
Inne aniony
|
Dwusiarczek rutenu |
|
Inne kationy
|
Tlenek osmu(IV) |
| Czterotlenek rutenu | |
| Strona z danymi uzupełniającymi | |
|
Współczynnik załamania ( n ), stała dielektryczna (ε r ) itp. |
|
|
Dane termodynamiczne |
Zachowanie fazowe ciało stałe-ciecz-gaz |
| UV , IR , NMR , MS | |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Rutenu (IV) jest związek nieorganiczny o wzorze Ru O 2 . To czarne ciało stałe jest najpowszechniejszym tlenkiem rutenu . Jest szeroko stosowany jako elektrokatalizator do produkcji chloru, tlenków chloru, a katalizatorem O 2 jest tlenek rutenu(IV). Jak wiele dwutlenków, RuO 2 przyjmuje strukturę rutylową .
Przygotowanie
Zwykle wytwarza się go przez utlenianie trójchlorku rutenu . Prawie stechiometryczne monokryształy RuO 2 można uzyskać poprzez chemiczny transport pary , wykorzystując O 2 jako środek transportu:
- RuO 2 + O 2 RuO 4
Folie RuO 2 można wytwarzać metodą chemicznego osadzania z fazy gazowej (CVD) z lotnych związków rutenu. RuO 2 można również wytwarzać przez galwanizację z roztworu trójchlorku rutenu.
Elektrostatycznie stabilizowane hydrozole nieskazitelnego hydratu ditlenku rutenu otrzymano wykorzystując autokatalityczną redukcję tetratlenku rutenu w roztworze wodnym. Uzyskane populacje cząstek można kontrolować tak, aby zawierały zasadniczo monodyspersyjne, jednorodne kulki o średnicach w zakresie 40 nm - 160 nm.
Zastosowania
Tlenek rutenu (IV) jest używany jako główny składnik katalizatora procesu Sumitomo- Deacon, w którym wytwarzany jest chlor poprzez utlenianie chlorowodoru .
RuO 2 może być stosowany jako katalizator w wielu innych sytuacjach. Reakcje uwagę zasługują procesu Fischera-Tropscha , proces Habera-Boscha i różne przejawy ogniw paliwowych .
Potencjalne i niszowe zastosowania
RuO 2 jest szeroko stosowany do powlekania anod tytanowych do elektrolitycznej produkcji chloru oraz do przygotowania rezystorów lub układów scalonych . Rezystory z tlenku rutenu mogą być stosowane jako czułe termometry w zakresie temperatur 0,02 < T < 4 K. Może być również stosowany jako materiał aktywny w superkondensatorze, ponieważ ma bardzo wysoką zdolność przenoszenia ładunku. Tlenek rutenu ma dużą zdolność magazynowania ładunku, gdy jest stosowany w roztworach wodnych. Średnie wydajności tlenku rutenu(IV) osiągnęły 650 F/g w roztworze H 2 SO 4 i wygrzaniu w temperaturach niższych niż 200 °C. Próbując zoptymalizować jego właściwości pojemnościowe, wcześniejsze prace dotyczyły hydratacji tlenku rutenu, jego krystaliczności i wielkości cząstek.
