Sonic jeż - Sonic hedgehog
Sonic hedgehog to białko kodowane przez gen SHH. Ta cząsteczka sygnałowa jest kluczowa w regulacji morfogenezy embrionalnej u wszystkich różnych typów zwierząt. SHH kontroluje organogenezę i organizację ośrodkowego układu nerwowego, kończyn, palców i wielu innych części ciała. Sonic hedgehog jest morfogenem, który modeluje rozwijający się zarodek przy użyciu gradientu stężeń charakterystycznego dla modelu flagi francuskiej . Model ten charakteryzuje się nierównomiernym rozmieszczeniem cząsteczek SHH, które regulują różne losy komórek w zależności od stężenia. Mutacje w tym genie mogą powodować holoprosencephaly , niepowodzenie rozszczepienia w półkulach mózgowych, jak wykazano w eksperymencie z użyciem myszy z nokautem SHH, w którym linia środkowa przodomózgowia nie rozwinęła się, a zamiast tego powstał tylko jeden zrośnięty pęcherzyk kresomózgowia. Sonic hedgehog nadal odgrywa rolę w różnicowaniu, proliferacji i utrzymaniu dorosłych tkanek. Nieprawidłowa aktywacja sygnalizacji SHH w tkankach dorosłych jest powiązana z różnymi typami nowotworów, w tym rakami piersi, skóry, mózgu, wątroby, pęcherzyka żółciowego i wielu innych.
Odkrycie i nazewnictwo
Jeż gen ( hh ) został po raz pierwszy zidentyfikowany w muszki owocowej Drosophila melanogaster w klasycznych ekranów Heidelberg od Christiane Nüsslein-Volhard i Eric Wieschaus , opublikowana w 1980 roku Te ekrany -co doprowadziło do nich zdobywając Nagrodę Nobla w 1995 roku, wraz z genetyk rozwoju Edward B. Lewis —zidentyfikował geny, które kontrolują wzór segmentacji zarodków Drosophila . HH utrata funkcji zmutowany fenotyp powoduje, że zarodki są pokryte wyrostki, czyli małe występy przypominające kolce spiczastych o jeża . Badania Philipa Inghama , Andrew P. McMahona i Clifforda Tabina, mające na celu znalezienie odpowiednika jeża u kręgowców , ujawniły trzy homologiczne geny .
Dwa z tych genes- pustyni jeża i Indian jeża -were nazwany gatunków jeży, a Sonic Hedgehog została nazwana Sonic the Hedgehog , tytułowej bohaterki z tytułowej serii gier wideo . Gen został tak nazwany przez Roberta Riddle'a, który był doktorantem w Tabin Lab , po tym, jak jego żona Betsy Wilder wróciła do domu z magazynem o grach zawierającym reklamę gry wideo Sonic the Hedgehog . W danio pręgowanego , dwa z trzech kręgowych hh geny są duplikowane: SHH i SHH b (dawniej określane jako tiggywinkle jeż , nazwany dla Pani Mrugalska , postać z Beatrix Potter książek jest dla dzieci) i ihha i ihhb ( dawniej opisywany jako jeż echidna , nazwany na cześć mrówkojada kolczastego, a nie od postaci Knuckles the Echidna z serii Sonic ).
Funkcjonować
Spośród homologów hh , SHH odgrywa najistotniejszą rolę w rozwoju, działając jako morfogen biorący udział w kształtowaniu wielu układów – w tym przedniej przysadki mózgowej , paliusza mózgu, rdzenia kręgowego , płuc , zębów i wzgórza przez strefę ograniczenia wewnątrzwzgórzowe . W kręgowców rozwój od kończyn i cyfr zależy od wydzielania Sonic hedgehog przez strefę aktywności polaryzacyjnej , znajduje się na tylnej stronie embrionalnym kończyn zarodku . Mutacje w ludzkim genie dźwięku jeż cii przyczyny holoprosencefalię typ 3 HPE3, w wyniku utraty brzusznej środkowej. Szlak transkrypcji sonic hedgehog został również powiązany z powstawaniem określonych rodzajów guzów nowotworowych, w tym embrionalnego guza móżdżku i rdzeniaka , a także z progresją guzów raka prostaty . Aby SHH ulegało ekspresji w rozwijających się kończynach zarodka, morfogen zwany czynnikami wzrostu fibroblastów musi być wydzielany z wierzchołkowego grzbietu ektodermalnego .
Wykazano również, że Sonic hedgehog działa jako wskazówka aksonalna . Wykazano, że SHH przyciąga spoidłowe aksony w brzusznej linii środkowej rozwijającego się rdzenia kręgowego. W szczególności SHH przyciąga aksony komórek zwojowych siatkówki (RGC) w niskich stężeniach i odpycha je w wyższych stężeniach. Wykazano, że brak (brak ekspresji) SHH kontroluje wzrost powstających tylnych kończyn u waleni ( wielorybów i delfinów ).
SHH gen jest członkiem rodziny genów hedgehog pięciu odmianach zmiany sekwencji DNA lub sklejenia wariantów. SHH znajduje się na chromosomie siódmym i inicjuje produkcję białka Sonic Hedgehog. Białko to wysyła sygnały o krótkim i dalekim zasięgu do tkanek embrionalnych w celu regulacji rozwoju. Jeśli gen SHH jest zmutowany lub nieobecny, białko Sonic Hedgehog nie może prawidłowo wykonywać swojej pracy. Sonic hedgehog przyczynia się do wzrostu komórek, specyfikacji i tworzenia komórek, strukturyzacji i organizacji planu ciała. Białko to działa jako istotna morfogeniczna cząsteczka sygnałowa i odgrywa ważną rolę w tworzeniu wielu różnych struktur w rozwijających się zarodkach. SHH gen wpływa kilka ważnych narządów, takich jak układu nerwowego, układu sercowo-naczyniowego, układu oddechowego, układu mięśniowo-szkieletowego. Mutacje w genie SHH mogą powodować wady rozwojowe elementów tych układów, co może skutkować poważnymi problemami w rozwijającym się zarodku. Na przykład na mózg i oczy mogą wpływać mutacje w tym genie i powodować zaburzenia, takie jak mikroftalmia i holoprosencephaly . Mikroftalmia to stan, który wpływa na oczy, co skutkuje małymi, słabo rozwiniętymi tkankami w jednym lub obu oczach. Może to prowadzić do problemów, od colobomy przez pojedyncze małe oko do całkowitego braku oczu. Holoprosencefalia to schorzenie najczęściej spowodowane mutacją genu SHH, która powoduje nieprawidłowe oddzielenie lewej i prawej części mózgu oraz dysmorfię twarzy. Wiele systemów i struktur polega w dużej mierze na prawidłowej ekspresji genu SHH i późniejszego białka sonic hedgehog, dzięki czemu wyróżnia się jako gen niezbędny do rozwoju.
Modelowanie ośrodkowego układu nerwowego
Cząsteczka sygnałowa Sonic hedgehog (SHH) odgrywa różne role w kształtowaniu ośrodkowego układu nerwowego (OUN) podczas rozwoju kręgowców . Jedną z najbardziej scharakteryzowanych funkcji SHH jest jego rola w indukcji płytki podłogowej i różnych typów komórek brzusznych w obrębie cewy nerwowej . Struny grzbietowej -a strukturę pochodzącą z osiowym mezodermy -produces SHH, który porusza się na zewnątrz komórki z regionu brzusznego cewy nerwowej i instruuje te komórki, tworząc płytę podłogową. Inny pogląd na indukcję płyty podłogowej stawia hipotezę, że niektóre komórki prekursorowe znajdujące się w strunie grzbietowej są wprowadzane do płyty nerwowej przed jej uformowaniem, co później powoduje powstanie płyty podłogowej.
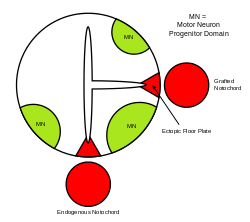
Sama cewa nerwowa jest początkowym podłożem OUN kręgowców , a płyta podłogowa jest wyspecjalizowaną strukturą, zlokalizowaną w brzusznym punkcie środkowym cewy nerwowej. Dowody potwierdzające, że struna grzbietowa jako centrum sygnalizacyjne pochodzi z badań, w których druga struna grzbietowa jest wszczepiana in vivo w pobliżu cewy nerwowej, co prowadzi do powstania ektopowej płytki podłogowej w cewce nerwowej.
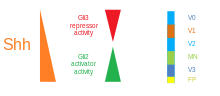
Sonic hedgehog to wydzielane białko, które pośredniczy w czynnościach sygnalizacyjnych struny grzbietowej i płytki podłogowej. Badania przeprowadzone ektopowej ekspresji z SHH in vitro i in vivo w rezultacie do indukcji płyty podłogi i różnicowania w neuronu ruchowego i brzusznej interneuronów . Z drugiej strony, myszy zmutowane pod kątem SHH nie mają cech brzusznej części rdzenia kręgowego. Blokowanie in vitro sygnalizacji SHH przy użyciu przeciwciał przeciwko niemu wykazuje podobne fenotypy. SHH wywiera swoje działanie w sposób zależny od stężenia, dlatego, że wysokie stężenie SHH prowadzi do miejscowego hamowania z proliferacją komórkową . To hamowanie powoduje, że płyta podłogowa staje się cienka w porównaniu z bocznymi obszarami cewy nerwowej . Niższe stężenie SHH powoduje proliferację komórkową i indukcję różnych typów komórek nerwowych brzusznych. Po ustanowieniu płytki podłogowej komórki znajdujące się w tym regionie będą następnie same wyrażać SHH, generując gradient stężenia w cewce nerwowej.
Chociaż nie ma bezpośrednich dowodów na gradient SHH , istnieją dowody pośrednie poprzez wizualizację ekspresji genu Patched ( Ptc ) , który koduje domenę wiążącą ligand receptora SHH w całej brzusznej cewce nerwowej. Badania in vitro pokazują, że przyrostowe dwu- i trzykrotne zmiany stężenia SHH prowadzą do powstania neuronu ruchowego i różnych podtypów międzyneuronalnych występujących w brzusznej części rdzenia kręgowego. Te narastające zmiany in vitro odpowiadają odległości domen od tkanki sygnalizacyjnej (struna grzbietowa i płytka podłogowa), która następnie różnicuje się do różnych podtypów neuronalnych, jak to zachodzi in vitro . Sugeruje się, że w stopniowanej sygnalizacji SHH pośredniczy rodzina białek Gli , które są homologami kręgowców czynnika transkrypcyjnego Cubitus interruptus zawierającego palec cynkowy Drosophila ( Ci ). Ci jest kluczowym mediatorem sygnalizacji jeża ( Hh ) u Drosophila . U kręgowców obecne są trzy różne białka Gli, mianowicie. Gli1 , Gli2 i Gli3 , które są wyrażane w cewce nerwowej. Mutanty myszy dla Gli1 wykazują prawidłowy rozwój rdzenia kręgowego, co sugeruje, że jest on zbędny w pośredniczeniu w aktywności SHH. Jednak myszy z mutantem Gli2 wykazują nieprawidłowości w brzusznej części rdzenia kręgowego, z poważnymi defektami w płycie podłogowej i najbardziej brzusznych interneuronach (V3). Gli3 antagonizuje funkcję SHH w sposób zależny od dawki, promując podtypy neuronów grzbietowych. Zmutowane fenotypy SHH można uratować w podwójnym mutancie SHH/Gli3 . Białka Gli mają C-końcową domenę aktywacyjną i N-końcową domenę represyjną.
Sugeruje się, że SHH promuje funkcję aktywacji Gli2 i hamuje represyjną aktywność Gli3. SHH również wydaje się promować funkcję aktywacji Gli3, ale ta aktywność nie jest wystarczająco silna. Stopniowe stężenie SHH prowadzi do stopniowej aktywności Gli 2 i Gli3, które promują brzuszne i grzbietowe podtypy neuronalne w brzusznej części rdzenia kręgowego. Dowody z mutantów Gli3 i SHH/Gli3 pokazują, że SHH przede wszystkim reguluje przestrzenne ograniczenie domen progenitorowych , a nie jest indukcyjne, ponieważ mutanty SHH/Gli3 wykazują mieszanie typów komórek.
SHH indukuje również inne białka, z którymi oddziałuje, a te interakcje mogą wpływać na wrażliwość komórki na SHH. Białko oddziałujące z jeżem ( HHIP ) jest indukowane przez SHH, co z kolei osłabia jego aktywność sygnalizacyjną. Vitronektyna jest kolejnym białkiem indukowanym przez SHH; działa jako obowiązkowy kofaktor sygnalizacji SHH w cewce nerwowej.
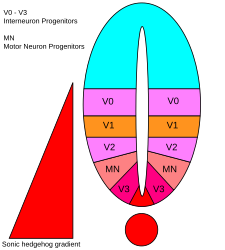
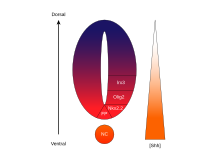
Istnieje pięć odrębnych domen progenitorowych w brzusznej cewce nerwowej: interneurony V3 , neurony ruchowe (MN), interneurony V2 , V1 i V0 (w kolejności od brzusznej do grzbietowej). Te różne domeny progenitorowe są ustalane przez „komunikację” między różnymi klasami czynników transkrypcyjnych homeoboxów . (Patrz Nerw trójdzielny ). Te czynniki transkrypcyjne reagują na stężenie gradientu SHH. W zależności od charakteru ich interakcji z SHH, są one podzielone na dwie grupy, klasy I i klasy II i składają się z członków Pax , NKX , DBX i IRX rodzin. Białka klasy I ulegają represji na różnych progach SHH wyznaczających brzuszne granice domen progenitorowych , podczas gdy białka klasy II są aktywowane na różnych progach SHH wyznaczających granicę grzbietową domen. Selektywne interakcje krzyżowo- represyjne między białkami klasy I i klasy II prowadzą do powstania pięciu kardynalnych podtypów neuronów brzusznych.
Należy zauważyć, że SHH nie jest jedyną cząsteczką sygnalizacyjną wywierającą wpływ na rozwijającą się cewę nerwową. Wiele innych cząsteczek, szlaków i mechanizmów jest aktywnych (np. RA , FGF , BMP ) i możliwe są złożone interakcje między SHH a innymi cząsteczkami. Sugeruje się, że BMP odgrywają kluczową rolę w określaniu wrażliwości komórek nerwowych na sygnalizację SHH. Dowody na to potwierdzające pochodzą z badań z użyciem inhibitorów BMP, które uwidaczniają los komórki płytki nerwowej dla danego stężenia SHH. Z drugiej strony, mutacja w antagonistach BMP (np. noggin ) powoduje poważne defekty w najbardziej brzusznych cechach rdzenia kręgowego, po których następuje ektopowa ekspresja BMP w brzusznej cewce nerwowej. Interakcje SHH z Fgf i RA nie zostały jeszcze zbadane szczegółowo molekularnie.
Aktywność morfogenetyczna
Zależna od stężenia i czasu aktywność SHH determinująca los komórek w brzusznej cewce nerwowej czyni go doskonałym przykładem morfogenu . U kręgowców sygnalizacja SHH w brzusznej części cewy nerwowej jest w szczególności odpowiedzialna za indukcję komórek płytki podłogowej i neuronów ruchowych . Cii wypływa z struny grzbietowej i brzusznej podłogowej płycie rozwijającego cewy nerwowej do tworzenia gradientu stężenia , który obejmuje oś grzbietowo-brzuszne i antagonizowane przez odwrotny Wnt gradientu, który określa grzbietowego rdzenia akordu. Wyższe stężenia ligandu SHH występują w najbardziej brzusznych częściach cewy nerwowej i struny grzbietowej, podczas gdy niższe stężenia znajdują się w bardziej grzbietowych obszarach cewy nerwowej. Gradient stężenia SHH uwidoczniono w cewce nerwowej myszy zmodyfikowanej do ekspresji białka fuzyjnego SHH::GFP, aby pokazać ten stopniowany rozkład SHH w czasie wzorcowania cewy nerwowej brzusznej.
Uważa się , że gradient SHH działa w celu wywołania wielu różnych losów komórek przez mechanizm zależny od stężenia i czasu , który indukuje różne czynniki transkrypcyjne w brzusznych komórkach progenitorowych . Każda z brzusznych domen progenitorowych wyraża wysoce zindywidualizowaną kombinację czynników transkrypcyjnych — Nkx2.2, Olig2, Nkx6.1, Nkx6.2, Dbx1, Dbx2, Irx3, Pax6 i Pax7 — która jest regulowana przez gradient SHH. Te czynniki transkrypcyjne są indukowane sekwencyjnie wzdłuż gradientu stężenia SHH w odniesieniu do ilości i czasu ekspozycji na ligand SHH. Ponieważ każda populacja komórek progenitorowych reaguje na różne poziomy białka SHH, zaczynają one wyrażać unikalną kombinację czynników transkrypcyjnych, która prowadzi do różnicowania losu komórek nerwowych. Ta indukowana przez SHH zróżnicowana ekspresja genów tworzy ostre granice między odrębnymi domenami ekspresji czynnika transkrypcyjnego, które ostatecznie kształtują brzuszną cewę nerwową.
Przestrzenny i czasowy aspekt postępującej indukcji genów i losów komórek w brzusznej cewce nerwowej ilustrują domeny ekspresji dwóch najlepiej scharakteryzowanych czynników transkrypcyjnych, Olig2 i Nkx2.2. Na wczesnym etapie rozwoju komórki w linii środkowej brzusznej były wystawione na niskie stężenie SHH przez stosunkowo krótki czas i eksprymowały czynnik transkrypcyjny Olig2. Ekspresja Olig2 gwałtownie rozszerza się w kierunku grzbietowym wraz z ciągłym rozszerzaniem grzbietowym gradientu SHH w czasie. Jednakże, gdy morfogenetyczny front ligandu SHH porusza się i zaczyna rosnąć bardziej skoncentrowany, komórki wystawione na wyższe poziomy ligandu odpowiadają wyłączając Olig2 i włączając Nkx2.2, tworząc ostrą granicę między komórkami wyrażającymi czynnik transkrypcyjny Nkx2.2 brzusznie do komórek wyrażających Olig2. W ten sposób uważa się, że każda z domen sześciu populacji komórek progenitorowych jest kolejno ukształtowana w cewce nerwowej przez gradient stężenia SHH. Wzajemne hamowanie między parami czynników transkrypcyjnych wyrażanych w sąsiednich domenach przyczynia się do rozwoju ostrych granic; jednak w niektórych przypadkach związek hamujący stwierdzono nawet między parami czynników transkrypcyjnych z bardziej odległych domen. W szczególności doniesiono , że NKX2-2 ulegający ekspresji w domenie V3 hamuje IRX3 wyrażany w V2 i większej liczbie domen grzbietowych, chociaż V3 i V2 są oddzielone dalszą domeną zwaną MN.
Ekspresja SHH w czołowonosowej strefie ektodermalnej (FEZ), która jest ośrodkiem sygnalizacyjnym odpowiedzialnym za wzorcowy rozwój szczęki, reguluje rozwój twarzoczaszki za pośrednictwem rodziny miR-199 w WSE. W szczególności, zależne od SHH sygnały z mózgu regulują geny z rodziny miR-199 z regulacją w dół genów miR-199 zwiększających ekspresję SHH i skutkującą szerszymi twarzami, podczas gdy regulacja w górę genów miR-199 zmniejsza ekspresję SHH, powodując wąskie twarze.
Rozwój zębów
Sonic hedgehog (SHH) to cząsteczka sygnalizacyjna kodowana przez ten sam gen sonic hedgehog. SHH odgrywa bardzo ważną rolę w organogenezie i, co najważniejsze, rozwoju twarzoczaszki. Ponieważ SHH jest cząsteczką sygnalizacyjną, działa głównie poprzez dyfuzję wzdłuż gradientu stężenia, wpływając na komórki na różne sposoby. Na wczesnym etapie rozwoju zęba SHH jest uwalniany z pierwotnego węzła szkliwa — centrum sygnalizacji — w celu dostarczenia informacji o położeniu zarówno we wzorcu sygnalizacji bocznej, jak i planarnej w rozwoju zęba i regulacji wzrostu guzka zęba. SHH jest szczególnie potrzebne do wzrostu nabłonkowych pętli szyjnych, gdzie nabłonek zewnętrzny i wewnętrzny łączą się i tworzą zbiornik dla komórek macierzystych zębów. Po apoptozie pierwotnych sęków szkliwa tworzą się wtórne sęki szkliwa. Wtórne węzły szkliwa wydzielają SHH w połączeniu z innymi cząsteczkami sygnałowymi, aby pogrubić ektodermę jamy ustnej i rozpocząć modelowanie złożonych kształtów korony zęba podczas różnicowania i mineralizacji. W modelu genu knockout brak SHH wskazuje na holoprosencefalię . Jednak SHH aktywuje dalsze cząsteczki Gli2 i Gli3. Zmutowane zarodki Gli2 i Gli3 mają nieprawidłowy rozwój siekaczy, które są zatrzymane we wczesnym rozwoju zębów, a także małych zębów trzonowych.
Rozwój płuc
Chociaż SHH jest najczęściej związane z rozwojem palców mózgu i kończyn, jest również ważne w rozwoju płuc. Badania z użyciem qPCR i knockoutów wykazały, że SHH przyczynia się do rozwoju embrionalnego płuc. Rozgałęzienia płuc ssaków występują w nabłonku rozwijających się oskrzeli i płuc. SHH ulega ekspresji w endodermie przedniej części jelita (najbardziej wewnętrzna z trzech listków zarodkowych) w dystalnym nabłonku, gdzie rozwijają się embrionalne płuca. Sugeruje to, że SHH jest częściowo odpowiedzialny za rozgałęzienie płuc. Dalsze dowody na rolę SHH w rozgałęzianiu płuc zaobserwowano w przypadku qPCR. Ekspresja SHH występuje w rozwijających się płucach około 11 dnia embrionalnego i jest silnie wyrażana w zawiązkach płuc płodowych, ale słaba w rozwijających się oskrzelach. Myszy z niedoborem SHH mogą rozwinąć przetokę tchawiczo-przełykową (nieprawidłowe połączenie przełyku i tchawicy). Dodatkowo, mysi model z podwójnym nokautem (SHH-/-) wykazywał słaby rozwój płuc. Płuca z podwójnym nokautem SHH nie przeszły lobacji i rozgałęzienia (tj. nieprawidłowe płuca rozwinęły tylko jedną gałąź w porównaniu z ekstensywnie rozgałęzionym fenotypem typu dzikiego).
Potencjalna funkcja regeneracyjna
Sonic hedgehog może odgrywać rolę w regeneracji komórek rzęsatych ssaków . Modulując białka glejaka siatkówki aktywność w ślimaku szczura Sonic hedgehog pozwala dojrzałe komórki do włosów , które zwykle nie może powrócić do stanu proliferacyjnego do podziału i różnicowania. Białka siatkówczaka hamują wzrost komórek, zapobiegając ich powrotowi do cyklu komórkowego , zapobiegając w ten sposób proliferacji. Wydaje się, że hamowanie aktywności Rb umożliwia podział komórek. Dlatego sonic hedgehog – zidentyfikowany jako ważny regulator Rb – może również okazać się ważną cechą w odrastaniu komórek rzęsatych po uszkodzeniu.
SHH jest ważne dla regulacji adipogenezy skóry przez komórki wzmacniające przejście mieszków włosowych (HF-TAC). W szczególności SHH indukuje angiogenezę skórną działając bezpośrednio na prekursory adipocytów i promując ich proliferację poprzez ekspresję genu receptora aktywowanego przez proliferatory peroksysomów γ (Pparg).
Przetwarzanie
SHH przechodzi szereg etapów przetwarzania, zanim zostanie wydzielony z komórki. Nowo zsyntetyzowane SHH waży 45 kDa i jest określane jako preproproteina. Jako białko sekrecyjne zawiera na swoim N-końcu krótką sekwencję sygnałową , która jest rozpoznawana przez cząsteczkę rozpoznającą sygnał podczas translokacji do retikulum endoplazmatycznego (ER), pierwszego etapu sekrecji białka . Po zakończeniu translokacji sekwencja sygnałowa jest usuwana przez peptydazę sygnałową w ER. Tam SHH przechodzi autoprzetwarzanie w celu wygenerowania N-końcowej domeny sygnalizacyjnej o masie 20 kDa (SHH-N) i C-końcowej domeny o masie 25 kDa bez znanej roli sygnalizacyjnej. Rozszczepienie jest katalizowane przez proteazę w obrębie domeny C-końcowej. Podczas reakcji do C-końca SHH-N dodawana jest cząsteczka cholesterolu . Zatem domena C-końcowa działa jako transferaza inteiny i cholesterolu. Inne hydrofobowe ugrupowanie , palmitynian , dodaje się do alfa-aminy N-końcowej cysteiny SHH-N. Ta zmiana jest wymagana dla wydajnego sygnalizowania, w wyniku 30-krotnego wzrostu siły na formie nie palmitylated jest przeprowadzane przez członka związanego z membraną O-acylotransferazy rodziny białek-cysteiny, N-palmitoilotransferazy HHAT .
Robotnikinin
Potencjalny inhibitor szlaku sygnałowego Hedgehog został znaleziony i nazwany „Robotnikinin” – na cześć wroga Sonic the Hedgehog, dr Ivo „Eggman” Robotnik .
Dawne kontrowersje wokół nazwy
Gen został powiązany ze stanem znanym jako holoprosencephaly , który może skutkować poważnymi wadami mózgu, czaszki i twarzy, co powoduje, że niektórzy klinicyści i naukowcy krytykują tę nazwę, ponieważ brzmi ona zbyt niepoważnie. Zauważono, że wzmianka o mutacji w genie sonic hedgehog może nie zostać dobrze przyjęta w dyskusji na temat poważnego zaburzenia z pacjentem lub jego rodziną. Kontrowersje te w dużej mierze ucichły, a nazwa jest obecnie powszechnie postrzegana jako humorystyczny relikt czasu sprzed powstania szybkiego, taniego sekwencjonowania pełnego genomu i znormalizowanej nomenklatury. Problemu „nieadekwatności” nazw genów, takich jak „Matki przeciwko decapentaplegii” , „Lunatic fringe” i „Sonic hedgehog” w dużej mierze omija się, stosując ustandaryzowane skróty w rozmowach z pacjentami i ich rodzinami.
Galeria
Zobacz też
- Pikachurin , białko siatkówki nazwane na cześć Pikachu
- Zbtb7 , onkogen , który pierwotnie nazywał się " Pokémon "
Bibliografia
Dalsza lektura
- Dorus S, Anderson JR, Vallender EJ, Gilbert SL, Zhang L, Chemnick LG, Ryder OA, Li W, Lahn BT (2006). „Sonic Hedgehog, kluczowy gen rozwojowy, doświadczył zintensyfikowanej ewolucji molekularnej u naczelnych” . Genetyka molekularna człowieka . 15 (13): 2031-7. doi : 10,1093/hmg/ddl123 . PMID 16687440 .
- Gilbert, Scott F. (2000). Biologia rozwoju (wyd. 6). Sunderland, Mass: Sinauer Associates. Numer ISBN 978-0-87893-243-6.
- Kim J, Kim P, Hui CC (2001). „Stowarzyszenie VACTERL: lekcje ze ścieżki Sonic Hedgehog”. Genetyka Kliniczna . 59 (5): 306–15. doi : 10.1034/j.1399-0004.2001.590503.x . PMID 11359461 . S2CID 34304310 .
- Morton JP, Lewis BC (2007). „Sygnalizacja SHH i rak trzustki: implikacje dla terapii?” . Cykl komórkowy . 6 (13): 1553–7. doi : 10.4161/cc.6.13.4467 . PMID 17611415 . S2CID 4670615 .
- Mullor JL, Sánchez P, Ruiz i Altaba A (2003). „Drogi i konsekwencje: sygnalizacja Hedgehog w chorobie człowieka”. Trendy Biol komórki . 12 (12): 562–9. doi : 10.1016/S0962-8924(02)02405-4 . PMID 12495844 .
- Nanni L, Ming JE, Du Y, Hall RK, Aldred M, Bankier A, Muenke M (2001). „Mutacja SHH jest związana z samotnym środkowym siekaczem centralnym szczęki: badanie 13 pacjentów i przegląd piśmiennictwa”. American Journal of Medical Genetics . 102 (1): 1–10. doi : 10.1002/1096-8628(20010722)102:1<1::AID-AJMG1336>3.0.CO;2-U . PMID 11471164 .
- Williams JA (2006). „Uraz jeża i rdzenia kręgowego”. Opinia eksperta na temat celów terapeutycznych . 9 (6): 1137–45. doi : 10.1517/14728222.9.6.1137 . PMID 16300466 . S2CID 5548531 .
Zewnętrzne linki
- Artykuł wprowadzający na temat SHH w Davidson College
- Odkrywanie biologii: Unit 7 Genetyka rozwoju.. Transkrypcje wywiadów eksperckich Wywiad z dr Johnem Incardoną .. wyjaśnienie odkrycia i nazewnictwa genu sonic hedgehog
- 'Sonic Hedgehog' z początku brzmiał śmiesznie .. New York Times 12 listopada 2006 ..
- Wpis GeneReviews/NCBI/NIH/UW na temat przeglądu anoktalmii/mikroftalmii
- SHH – sonic jeż US National Library of Medicine
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : Q15465 (Human Sonic hedgehog protein) w PDBe-KB .
- Przegląd wszystkich informacji strukturalnych dostępnych w PDB dla UniProt : Q62226 (białko Mouse Sonic hedgehog) w PDBe-KB .