Stevens przegrupowanie - Stevens rearrangement
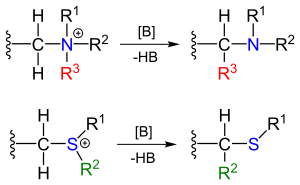
Stevensa przegrupowania w chemii organicznej jest organicznym reakcji konwersji czwartorzędowe sole amoniowe i sole sulfoniowe z odpowiednimi aminami lub siarczki w obecności silnej zasady w 1,2-przegrupowania .
Reagenty można otrzymać przez alkilowanie odpowiednich amin i siarczków. Podstawnik R obok aminy mostka metylenowego oznacza grupę odciągającą elektrony .
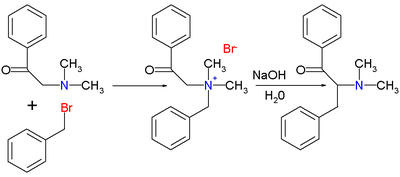
Oryginalna publikacja Thomasa S. Stevensa z 1928 r. Dotyczyła reakcji 1-fenylo-2- (N, N-dimetyloamino) etanonu z bromkiem benzylu do soli amonowej, a następnie reakcji przegrupowania z wodorotlenkiem sodu w wodzie do przegrupowanej aminy.
W publikacji z 1932 r. Opisano odpowiednią reakcję siarki.
Mechanizm reakcji
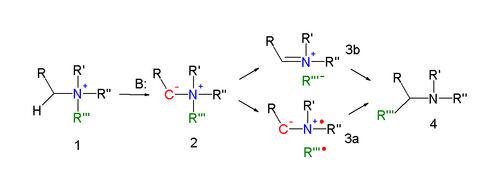
Mechanizm reakcji przegrupowania Stevensa jest jednym z najbardziej kontrowersyjnych mechanizmów reakcji w chemii organicznej. Kluczowym elementem mechanizmu reakcji przegrupowania Stevensa (wyjaśnionego dla reakcji azotu) jest tworzenie ylidu po deprotonowaniu soli amonowej silną zasadą. Deprotonację wspomagają właściwości odciągania elektronów podstawnika R. Dla właściwej reakcji przegrupowania istnieje kilka trybów reakcji.
Reakcja skoordynowana wymaga antarafacial tryb reakcji ale ponieważ migrujące wyświetla grupy retencję konfiguracji mechanizm ten jest mało prawdopodobne.
W alternatywnym mechanizmie reakcji wiązanie N – C grupy opuszczającej jest rozszczepiane homolitycznie, tworząc parę di-rodników ( 3a ). Aby wyjaśnić obserwowane zachowanie konfiguracji, powołano się na obecność klatki rozpuszczalnika . Inną możliwością jest utworzenie pary kation-anion ( 3b ), również w klatce z rozpuszczalnikiem.
Zakres
Konkurencyjne reakcje to przegrupowanie Sommeleta-Hausera i eliminacja Hofmanna .
W jednej aplikacji podwójna przegrupowanie Stevensa rozszerza pierścień cyklofanowy . Ylid wytwarza się in situ na drodze reakcji diazowania związku diazomalonianu etylu z siarczku katalizowanej dirodu tetraoctanu w wrzącym ksylenie .
Reakcja enzymatyczna
Ostatnio, γ-hydroksylazy butyrobetainy An enzym , który bierze udział w ludzkiej biosyntezy karnityny szlaku stwierdzono katalizują do wiązania CC reakcji tworzenia w sposób analogiczny do typu przegrupowania Stevensa. Substratem reakcji jest meldonium .