Reakcja eliminacji E1cB - E1cB-elimination reaction

Reakcję eliminacji E1cB jest typem reakcji eliminacji , który występuje w warunkach zasadowych, w których wodór jest usuwany jest względnie kwasowa, podczas gdy grupę opuszczającą (na przykład -OH lub -OR) jest stosunkowo słaba jeden. Zwykle obecna jest umiarkowana lub mocna zasada. E1cB to proces dwuetapowy, którego pierwszy krok może być odwracalny lub nie. Po pierwsze, zasada abstrahuje względnie kwaśny proton, aby wytworzyć stabilizowany anion . Wolna para elektronów na anionie przesuwa się następnie do sąsiedniego atomu, wyrzucając w ten sposób grupę opuszczającą i tworząc podwójne lub potrójne wiązanie . Nazwa mechanizmu - E1cB - oznacza E limination U nimolecular c onjugate B azy. Eliminacja odnosi się do faktu, że mechanizm jest reakcją eliminacji i spowoduje utratę dwóch podstawników. Unimolecular odnosi się do faktu, że etap determinujący szybkość tej reakcji obejmuje tylko jedną jednostkę molekularną . Wreszcie, zasada koniugatu odnosi się do tworzenia karboanionowego związku pośredniego , który jest koniugowaną zasadą materiału wyjściowego.
E1cB należy traktować jako znajdujący się na jednym końcu ciągłego widma, które obejmuje mechanizm E1 na przeciwległym końcu i mechanizm E2 pośrodku. Mechanizm E1 ma zwykle przeciwne cechy: grupa opuszczająca jest dobra (jak -OTs lub -Br), podczas gdy wodór nie jest szczególnie kwaśny i brak jest mocnej zasady. Tak więc w mechanizmie E1 grupa opuszczająca wychodzi pierwsza, aby wytworzyć karbokation. Ze względu na obecność pustego orbitalu p po odejściu grupy opuszczającej, wodór na sąsiednim węglu staje się znacznie bardziej kwaśny, co pozwala na jego usunięcie przez słabą zasadę w drugim etapie. W reakcji E2 obecność silnej zasady i dobrej grupy opuszczającej umożliwia jednoczesne oderwanie protonów przez zasadę i odejście grupy opuszczającej, co prowadzi do uzgodnionego stanu przejściowego w jednoetapowym procesie.
Mechanizm
Istnieją dwa główne wymagania, aby reakcja przebiegała mechanistyczną ścieżką E1cB. Związek musi mieć kwaśny wodór na węglu β i stosunkowo słabą grupę opuszczającą na węglu α . Pierwszym krokiem mechanizmu E1cB jest deprotonacja węgla β, w wyniku której powstaje anionowy stan przejściowy, taki jak karboanion. Im większa stabilność tego stanu przejściowego, tym bardziej mechanizm będzie faworyzował mechanizm E1cB. Ten stan przejściowy może być stabilizowana poprzez indukcję lub delokalizacji z elektronowego wolnej pary przez rezonans . Ogólnie można twierdzić, że grupa odciągająca elektrony na podłożu, silna zasada, słaba grupa opuszczająca i rozpuszczalnik polarny wyzwalają mechanizm E1cB. Przykładem mechanizmu E1cB, który ma stabilny stan przejściowy, jest degradacja etiofenkarbu – insektycydu karbaminianowego, który ma stosunkowo krótki okres półtrwania w ziemskiej atmosferze. Po deprotonowaniu aminy powstały amid jest względnie stabilny, ponieważ jest sprzężony z sąsiednim karbonylkiem . Oprócz tego, że zawiera kwaśny wodór na węglu β, potrzebna jest również stosunkowo słaba grupa opuszczająca. Zła grupa opuszczająca jest konieczna, ponieważ dobra grupa opuszczająca opuści się przed jonizacją cząsteczki. W rezultacie związek prawdopodobnie przejdzie przez szlak E2 . Niektóre przykłady związków, które zawierają słabe grupy opuszczające i mogą podlegać mechanizmowi E1cB, to alkohole i fluoroalkany . Zasugerowano również, że mechanizm E1cB występuje częściej wśród alkenów eliminujących do alkinów niż z alkanu do alkenu. Jednym z możliwych wyjaśnień tego jest to, że hybrydyzacja sp 2 tworzy nieco bardziej kwasowe protony. Chociaż ten mechanizm nie ogranicza się do eliminacji opartych na węglu . Zaobserwowano to w przypadku innych heteroatomów , takich jak azot, w eliminacji pochodnej fenolu z etiofenkarbu .

Odróżnianie reakcji eliminacji E1cB od reakcji eliminacji E1 i E2
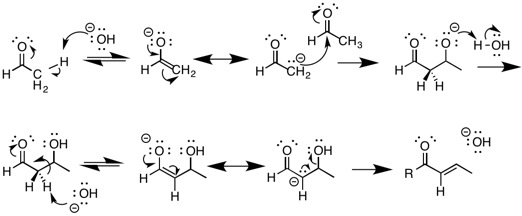
Wszystkie reakcje eliminacji obejmują usunięcie dwóch podstawników z pary atomów w związku. Powstaną alkeny, alkiny lub podobne odmiany heteroatomów (takie jak karbonyl i cyjano ). Mechanizm E1cB to tylko jeden z trzech rodzajów reakcji eliminacji. Pozostałe dwie reakcje eliminacji to reakcje E1 i E2. Chociaż mechanizmy są podobne, różnią się czasem deprotonowania węgla α i utraty grupy opuszczającej. E1 oznacza eliminację jednocząsteczkową, a E2 oznacza eliminację dwucząsteczkową. W mechanizmie E1 cząsteczka zawiera dobrą grupę opuszczającą, która odchodzi przed deprotonowaniem węgla α. Prowadzi to do powstania półproduktu karbokationowego. Karbokation jest następnie deprotonowany, w wyniku czego powstaje nowe wiązanie pi. Zaangażowana cząsteczka musi również mieć bardzo dobrą grupę opuszczającą, taką jak brom lub chlor, i powinna mieć stosunkowo mniej kwaśny węgiel α.
W reakcji eliminacji E2, zarówno deprotonowanie węgla α, jak i utrata grupy opuszczającej zachodzą jednocześnie w jednym skoordynowanym etapie. Cząsteczki podlegające mechanizmom eliminacji E2 mają więcej kwaśnych węgli α niż te, które podlegają mechanizmom E1, ale ich węgle α nie są tak kwaśne jak te z molekuł podlegających mechanizmom E1cB. Kluczową różnicą między szlakami E2 i E1cb jest odmienny pośredni karboanion, w przeciwieństwie do jednego wspólnego mechanizmu. Badania wykazały, że ścieżki różnią się przy użyciu różnych grup opuszczających halogen . Jeden przykład wykorzystuje chlor jako lepiej stabilizujący halogen dla anionu niż fluor , co sprawia, że fluor jest grupą opuszczającą, chociaż chlor jest znacznie lepszą grupą opuszczającą. Stanowi to dowód, że karboanion powstaje, ponieważ produkty nie są możliwe dzięki najbardziej stabilnemu mechanizmowi skoordynowanego E2 . Poniższa tabela podsumowuje kluczowe różnice między trzema reakcjami eliminacji; jednak najlepszym sposobem określenia, który mechanizm odgrywa kluczową rolę w określonej reakcji, jest zastosowanie kinetyki chemicznej .
| E1 | E2 | E1cB |
|---|---|---|
| Stopniowa reakcja | Zgodna reakcja | Stopniowa reakcja |
| Półprodukt karbokation | Jednoczesne usuwanie protonu, tworzenie podwójnego wiązania i utrata grupy opuszczającej | Karboanion pośredni |
| Silnie kwaśne media | Bez preferencji | Silnie podstawowe media |
| Dobre grupy opuszczające | Opuszczenie grupy | Słabe grupy opuszczające |
| Mniej kwaśny BH | Kwaśny BH | Bardziej kwaśny BH |
Kinetyka chemiczna mechanizmów eliminacji E1cB
Podczas próby ustalenia, czy reakcja przebiega zgodnie z mechanizmem E1cB, niezbędna jest kinetyka chemiczna . Najlepszym sposobem identyfikacji mechanizmu E1cB jest wykorzystanie praw kinetycznych i kinetycznego efektu izotopowego . Techniki te mogą również pomóc w dalszym różnicowaniu reakcji eliminacji E1cB, E1 i E2.
Prawo stawki
Podczas próby eksperymentalnego określenia, czy reakcja przebiega zgodnie z mechanizmem E1cB, niezbędna jest kinetyka chemiczna . Najlepsze sposoby identyfikacji mechanizmu E1cB obejmują zastosowanie praw szybkości i kinetycznego efektu izotopowego.
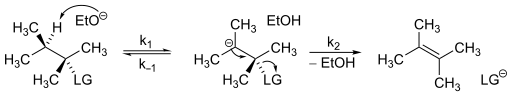
Prawo kinetyczne rządzące mechanizmami E1cB jest stosunkowo proste do wyznaczenia. Rozważ następujący schemat reakcji.
Zakładając, że w mechanizmie występuje koncentracja karboanionów w stanie ustalonym, równanie kinetyczne dla mechanizmu E1cB.
Z tego równania jasno wynika, że zostanie ujawniona kinetyka drugiego rzędu . Kinetyka mechanizmów E1cB może się nieznacznie różnić w zależności od szybkości każdego kroku. W rezultacie mechanizm E1cB można podzielić na trzy kategorie:
- Anion E1cB występuje wtedy, gdy karboanion jest stabilny i/lub mocna zasada jest stosowana w nadmiarze substratu, co powoduje, że deprotonacja jest nieodwracalna, po czym następuje determinująca szybkość utrata grupy opuszczającej (k 1 [zasada] ≫ k 2 ).
- E1cB rev jest wtedy, gdy pierwszy etap jest odwracalny, ale tworzenie produktu jest wolniejsze niż reformowanie materiału wyjściowego, co ponownie wynika z powolnego drugiego etapu (k- 1 [kwas sprzężony] ≫ k 2 ).
- E1cB irr ma miejsce, gdy pierwszy etap jest powolny, ale po utworzeniu anionu produkt szybko następuje (k 2 ≫ k -1 [kwas sprzężony]). Prowadzi to do nieodwracalnego pierwszego etapu, ale w przeciwieństwie do anionu E1cB , deprotonacja determinuje szybkość.
Kinetyczny efekt izotopowy
Deuter
Wymiana deuteru i kinetyczny efekt izotopowy deuteru mogą pomóc w rozróżnieniu między E1cB rev , E1cB anion i E1cB irr . Jeżeli jako rozpuszczalnik stosuje się protonowe i zawiera deuter w miejsce atomu wodoru (na przykład, CH 3 OD), a następnie wymianę protonów w materiale wyjściowym może być monitorowane. Jeżeli odzyskany materiał wyjściowy zawiera deuter, to reakcja najprawdopodobniej zachodzi w mechanizmie typu E1cB rev . Przypomnijmy, w tym mechanizmie protonowanie karboanionu (przez sprzężony kwas lub rozpuszczalnik) jest szybsze niż utrata grupy opuszczającej. Oznacza to, że po utworzeniu karboanionu szybko usunie proton z rozpuszczalnika, tworząc materiał wyjściowy.
Jeśli reagent zawiera deuter w pozycji β, pierwotny kinetyczny efekt izotopowy wskazuje, że deprotonacja determinuje szybkość. Spośród trzech mechanizmów E1cB ten wynik jest zgodny tylko z mechanizmem E1cB irr , ponieważ izotop jest już usunięty w anionie E1cB, a odejście z grupy jest determinujące szybkość w E1cB rev .
Fluor-19 i węgiel-11
Innym sposobem, w jaki kinetyczny efekt izotopowy może pomóc w rozróżnieniu mechanizmów E1cB, jest użycie 19 F. Fluor jest stosunkowo słabą grupą opuszczającą i jest często stosowany w mechanizmach E1cB. Kinetyczne efekty izotopowe fluoru są również stosowane w znakowaniu radiofarmaceutyków i innych związków w badaniach medycznych. Ten eksperyment jest bardzo przydatny w określaniu, czy utrata grupy opuszczającej jest krokiem determinującym szybkość w mechanizmie i może pomóc w rozróżnieniu między mechanizmami E1cB irr i E2. 11 C można również wykorzystać do zbadania natury struktury stanu przejściowego. Zastosowanie 11 C może być wykorzystane do badania powstawania karboanionu, a także badania jego czasu życia, co może nie tylko wykazać, że reakcja jest dwustopniowym mechanizmem E1cB (w przeciwieństwie do mechanizmu uzgodnionego E2), ale może również zająć się czasem życia i stabilnością struktury stanu przejściowego, która umożliwia dalsze rozróżnienie między trzema różnymi typami mechanizmów E1cB.
Reakcje aldolowe
Najbardziej znaną reakcją ulegającą eliminacji E1cB jest reakcja kondensacji aldolowej w warunkach zasadowych. Wiąże się to z deprotonowaniem związku zawierającego grupę karbonylową , co powoduje powstanie enolanu . Enolan jest bardzo stabilną zasadą koniugatu materiału wyjściowego i jest jednym z produktów pośrednich w reakcji. Ten enolan działa następnie jako nukleofil i może atakować aldehyd elektrofilowy. Produkt Aldol jest następnie deprotonowany tworząc inny enolan, po którym następuje eliminacja wody w reakcji odwodnienia E1cB . Reakcje aldolowe są kluczową reakcją w chemii organicznej, ponieważ zapewniają sposób tworzenia wiązań węgiel-węgiel, umożliwiając syntezę bardziej złożonych cząsteczek.
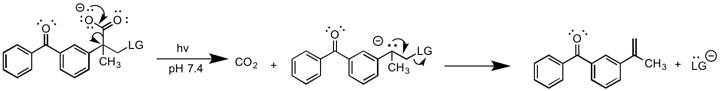
Fotoindukowane E1cB
Fotochemiczną wersję E1cB opisali Lukeman i in. W tym raporcie indukowana fotochemicznie reakcja dekarboksylacji generuje karboanionowy związek pośredni, który następnie eliminuje grupę opuszczającą. Reakcja jest unikalna w porównaniu z innymi formami E1cB, ponieważ nie wymaga zasady do wygenerowania karboanionu. Etap tworzenia karboanionu jest nieodwracalny i dlatego powinien być klasyfikowany jako E1cB irr .
W biologii
Reakcja eliminacji E1cB jest ważną reakcją w biologii. Na przykład przedostatni etap glikolizy obejmuje mechanizm E1cB. Ten etap obejmuje konwersję 2-fosfoglicerynianu do fosfoenolopirogronianu , wspomaganą przez enzym enolazę .



![Równanie kinetyczne i obserwowana szybkość mechanizmu eliminacji E1cB w poprzednim przykładzie, gdzie zasadą jest etanol. {\ Displaystyle {\ zacząć {wyrównany} {\ Frac {\ ce {d [P]}} {{\ ce {d}} t}} i = {\ Frac {k_ {1} k_ {2} {\ ce {[substrat][baza]}}}{k_{-1}[{\ce {koniugat\ kwas}}]+k_{2}}}\\{\ce {wskaźnik}}&=k_{\ce { obs}}{\ce {[podłoże][podstawa]}}\end{wyrównany}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9fcaecea886d403f885d43b58cfb946af0778938)