Chemia gospodarz-gość - Host–guest chemistry
W chemii supramolekularnego , chemia gospodarz-gość opisano kompleksy , które są złożone z dwóch lub więcej cząsteczek lub jonów , które są utrzymywane razem w unikalny związków strukturalnych przez siły inne niż pełnej wiązań kowalencyjnych . Chemia gospodarz-gość obejmuje ideę rozpoznawania molekularnego i interakcji poprzez wiązania niekowalencyjne . Wiązanie niekowalencyjne ma kluczowe znaczenie dla utrzymania trójwymiarowej struktury dużych cząsteczek, takich jak białka, i jest zaangażowane w wiele procesów biologicznych, w których duże cząsteczki wiążą się ze sobą specyficznie, ale przejściowo.
Chociaż interakcje niekowalencyjne mogą być z grubsza podzielone na te, bardziej elektrostatycznych lub dyspersyjnych wkładu, istnieje kilka powszechnie wspomniane typy współoddziaływania niekowalencyjne: wiązaniem jonowym , wiązanie wodorowe , siły van der Waalsa i oddziaływania hydrofobowe .


Przegląd
Chemia gospodarz-gość to gałąź chemii supramolekularnej, w której cząsteczka gospodarza tworzy związek chemiczny z cząsteczką gościa lub jonem. Dwa składniki związku są utrzymywane razem przez siły niekowalencyjne, najczęściej przez wiązanie wodorowe . Wiązanie między gospodarzem a gościem jest zwykle wysoce specyficzne dla dwóch odnośnych ugrupowań. Tworzenie tych kompleksów ma kluczowe znaczenie dla tematu rozpoznawania molekularnego .
Istnieje równowaga między stanem niezwiązanym, w którym gospodarz i gość są oddzieleni od siebie, a stanem związanym, w którym istnieje strukturalnie zdefiniowany kompleks gospodarz-gość:
- H ="gospodarz", G ="gość", HG ="kompleks gospodarz-gość"
Składnik „gospodarza” można uznać za większą cząsteczkę i obejmuje on mniejszą cząsteczkę „gościa”. W układach biologicznych analogiczne terminy gospodarz i gość są powszechnie określane odpowiednio jako enzym i substrat .
Aby zaprojektować systemy syntetyczne, które spełniają określone funkcje i zadania, bardzo ważne jest zrozumienie termodynamiki wiązania między gospodarzem a gościem. Chemicy koncentrują się na wymianie energii różnych oddziaływań wiążących i próbują opracować eksperymenty naukowe w celu ilościowego określenia podstawowych źródeł tych niekowalencyjnych oddziaływań przy użyciu różnych technik, takich jak spektroskopia NMR, spektroskopia UV/widzialna oraz kalorymetria izotermiczna. Analiza ilościowa stałych wartości wiązania dostarcza użytecznych informacji termodynamicznych.
Zasady termodynamiczne interakcji gospodarz-gość
Korzyści termodynamiczne z chemii gospodarz-gość wywodzą się z idei, że ogólna energia swobodna Gibbsa jest niższa z powodu interakcji między cząsteczkami gospodarza i gościa. Chemicy wyczerpująco próbują zmierzyć właściwości energetyczne i termodynamiczne tych niekowalencyjnych oddziaływań występujących w chemii supramolekularnej; i robiąc to mam nadzieję uzyskać dalszy wgląd w kombinatoryczne wyniki tych wielu, małych, niekowalencyjnych sił, które są wykorzystywane do generowania ogólnego efektu na strukturę supramolekularną.
Stała asocjacji , może być określona przez wyrażenie
gdzie {HG} jest termodynamiczną aktywnością kompleksu w równowadze. {H} reprezentuje aktywność gospodarza, a {G} aktywność gościa. Ilości , i są odpowiednimi stężeniami i są ilorazem współczynników aktywności .
W praktyce stałą równowagi określa się zwykle w kategoriach stężeń.
Gdy stosuje się tę definicję, zakłada się, że iloraz współczynników aktywności ma wartość liczbową jeden. Okazuje się wtedy, że stała równowagi ma wymiar 1/stężenie, ale to nie może być prawdą, ponieważ standardowa zmiana energii swobodnej Gibbsa jest proporcjonalna do logarytmu K .
Ta pozorna paradoksu jest rozwiązany, gdy wymiar jest zdefiniowane jako odwrotność wymiaru iloraz stężeń. Implikacja jest taka, że uważa się, że ma stałą wartość we wszystkich odpowiednich warunkach doświadczalnych. Niemniej jednak powszechną praktyką jest dołączanie wymiaru, takiego jak milimol na litr lub mikromol na litr, do wartości K , która została określona eksperymentalnie.
Duża wartość wskazuje, że cząsteczki gospodarza i gościa silnie oddziałują, tworząc kompleks gospodarz-gość.
Wyznaczanie wiążących wartości stałych
Prosta kompleksacja gospodarz-gość
Gdy cząsteczki gospodarza i gościa łączą się, tworząc jeden kompleks, równowaga jest reprezentowana jako
a stała równowagi K jest zdefiniowana jako
gdzie [X] oznacza stężenie substancji chemicznej X (przyjmuje się, że wszystkie współczynniki aktywności mają wartości liczbowe 1). Równania bilansu masy, w dowolnym punkcie danych,
gdzie i reprezentują łączne stężenia gospodarza i gościa, można zredukować do pojedynczego równania kwadratowego w, powiedzmy, [G], a więc można je rozwiązać analitycznie dla dowolnej danej wartości K. Stężenia [H] i [HG] można następnie wyprowadzone.
Następnym krokiem w obliczeniach jest obliczenie wartości , , ilości odpowiadającej obserwowanej ilości . Wtedy suma kwadratów U, po wszystkich punktach danych, np, może być zdefiniowana jako
i można to zminimalizować w odniesieniu do wartości stałej stabilności K i parametru takiego jak przesunięcie chemiczne gatunku HG (dane nmr) lub jego absorpcji molowej (dane uv/vis). Minimalizację można przeprowadzić w aplikacji arkusza kalkulacyjnego, takiej jak EXCEL, za pomocą wbudowanego narzędzia SOLVER.
Ta procedura powinna być stosowana tylko wtedy, gdy jest pewne, że addukt 1:1 jest jedynym utworzonym gatunkiem złożonym. Proste sprawdzenie poprawności tego twierdzenia polega na tym, że reszty powinny wykazywać losowy rozkład ; w przeciwnym razie należy rozważyć utworzenie drugiego gatunku, stosując metody opisane w następnym rozdziale.
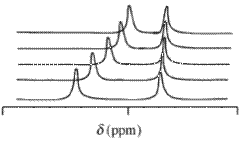
Dane magnetycznego rezonansu jądrowego (NMR)
W przypadku widm magnetycznego rezonansu jądrowego (NMR) obserwowana wartość przesunięcia chemicznego δ , powstająca od danego atomu zawartego w cząsteczce odczynnika i jednego lub więcej kompleksów tego odczynnika, będzie średnią ważoną stężenia wszystkich przesunięć tych związków chemicznych. Zakłada się, że wymiana chemiczna jest szybka w skali czasowej NMR. terminy ułamków molowych ,
jest przesunięciem chemicznym i- tego związku chemicznego, który zawiera jądro i jest stężeniem / ułamkiem molowym ( c jest stężeniem / mol dm −3 ) tego związku. Wyrażenie to ma taką samą formę matematyczną jak prawo Beera . Wartości przesunięcia chemicznego można uzyskać dla więcej niż jednego jądra w analogiczny sposób, że absorbancję można mierzyć przy więcej niż jednej długości fali. Typowe izotopów, które mogą być stosowane w tym kontekście, są 1 H, 13 ° C i 31 P. Jest to zazwyczaj stosuje się deuterowany rozpuszczalnika przy pomiarze 1 H wartości przesunięcia chemicznego.
Dane dotyczące absorbancji
Zakłada się, że absorbancja każdego gatunku jest proporcjonalna do stężenia tego gatunku, zgodnie z prawem Beera-Lamberta .
gdzie λ jest długością fali, jest długością drogi optycznej kuwety zawierającej roztwór związków N ( chromofory ), jest molową absorbancją (znaną również jako współczynnik ekstynkcji) i- tego związku chemicznego przy długości fali λ, c ja jest jego koncentracją. Gdy stężenia obliczono jak powyżej i zmierzono absorbancję dla próbek o różnych stężeniach gospodarza i gościa, prawo Beera-Lamberta zapewnia zestaw równań, przy danej długości fali, które można rozwiązać za pomocą liniowej najmniejszych kwadratów proces dla nieznanych wartości współczynnika ekstynkcji przy tej długości fali.
Dane dotyczące fluorescencji
Traktowanie tego typu danych jest podobne do traktowania danych dotyczących absorbancji. W rzeczywistości równanie określające zależność między intensywnością fluorescencji a stężeniami gatunków jest bardzo podobne.
gdzie jest intensywnością fluorescencji i-tego gatunku w stężeniu jednostkowym.
Kalorymetria
Ciepło wydzielone, gdy porcja roztworu gospodarza jest dodawana do roztworu zawierającego gościa, jest sumą wkładów z każdej reakcji
gdzie jest zmierzoną wartością zmiany ciepła (skorygowaną o wszystkie udziały ciepła z zewnątrz) w punkcie danych j , jest ilością pochłoniętego lub wyemitowanego ciepła, gdy powstaje 1 mol i- tego produktu reakcji i jest rzeczywistą zmianą liczby moli ten produkt w tym punkcie danych. oblicza się rozwiązując równania bilansu masy przy podanych wartościach stałych równowagi. Jeżeli znane są wartości stałej równowagi, standardową zmianę entalpii można obliczyć za pomocą liniowego procesu najmniejszych kwadratów, w przeciwnym razie należy zastosować nieliniową metodę dopasowywania danych.
Kalorymetria miareczkowa izotermiczna jest powszechnie stosowana do określenia wartości zarówno stałej równowagi, jak i odpowiadającej jej standardowej entalpii reakcji. Producenci przyrządów ITC dostarczają oprogramowanie, za pomocą którego można uzyskać te wielkości z wartości danych doświadczalnych.
Ogólna reakcja kompleksowania
Dla każdej równowagi obejmującej gospodarza, H i gościa G
stała równowagi, , jest zdefiniowana jako
Wartości wolnych stężeń i uzyskuje się rozwiązując równania bilansu masowego ze znanymi lub oszacowanymi wartościami stałych stabilności.
Następnie stężenia każdego złożonego gatunku można również obliczyć jako . Zależność między stężeniem gatunku a zmierzoną ilością jest specyficzna dla techniki pomiaru, jak wskazano w każdej sekcji powyżej. Wykorzystując tę zależność, zestaw parametrów, wartości stałych stabilności i wartości właściwości, takich jak chłonność molowa lub określone przesunięcia chemiczne, mogą być udokładniane za pomocą nieliniowego procesu udokładniania metodą najmniejszych kwadratów . Bardziej szczegółowe przedstawienie teorii patrz Wyznaczanie stałych równowagi . Niektóre dedykowane programy komputerowe są wymienione w sekcji Implementacje .
Wyznaczanie wartości entalpii standardowej i zmiany entropii
Rozważmy najpierw system, w którym rozwiązanie zawiera pewne ilości gospodarza H i gościa G w równowadze z pojedynczym kompleksem HG .
Załóżmy teraz, że niewielka ilość gościa jest dodawana do mieszaniny gospodarza i gościa w stanie równowagi. Nowa równowaga zostanie ustalone i ilość ciepła Q będą ewoluowały. Gdy ta wielkość została zmierzona i skorygowana o czynniki instrumentalne, jest to związane ze zmianą ilości kompleksu HG obecnego w roztworze.
gdzie Δ H ⊖ jest standardową entalpią tworzenia , czyli entalpią tworzenia 1 mola kompleksu, HG i jest zmianą liczby moli rodzaju HG w roztworze.
Jeśli znana jest wartość stałej równowagi, , można ją obliczyć, rozwiązując równania bilansu masy przed i po dodaniu (patrz #Proste kompleksowanie gospodarza i gościa powyżej). Następnie wartość Δ H ⊖ można otrzymać metodą liniowego dopasowania najmniejszych kwadratów do szeregu eksperymentalnych wartości Q .
Jeśli wartość K nie jest znana, należy przeprowadzić nieliniowe udokładnianie metodą najmniejszych kwadratów, aby uzyskać dwa parametry i . Gdy dane są uzyskiwane za pomocą kalorymetrii izotermicznej, oprogramowanie wymagane do obliczeń jest dostarczane przez producenta aparatu.
Uwaga: użycie równania van 't Hoffa do obliczenia standardowej zmiany entalpii jest przestarzałe, ponieważ wartość uzyskana tą metodą może być obarczona nadmiernym błędem .
Ogólnie rzecz biorąc, gdy tworzy się m kompleksów, ciepło powstające w k- tym punkcie „miareczkowania” jest sumą wkładów wynikających ze zmiany stężenia produktu reakcji.
Należy określić parametr 2m , standardową zmianę entalpii i stałą równowagi dla tworzenia każdego produktu reakcji. Producenci przyrządów ITC dostarczają kilka specyficznych produktów oprogramowania, za pomocą których można obliczyć wartości wielu parametrów. Programy komputerowe do ogólnego przypadku, takie jak HypΔH . Dostępne są również Affinimeter ITC .
Po określeniu wartości każdej standardowej zmiany entalpii i stałej równowagi, wartość odpowiadającej standardowej zmiany entropii można wyprowadzić z wyrażenia
w danej temperaturze T .
Techniki eksperymentalne
Magnetyczny rezonans jądrowy
Magnetyczny rezonans jądrowy (NMR) jest jedną z najpotężniejszych technik spektroskopowych w chemii analitycznej. Jest ważnym narzędziem do badań kompleksów gospodarz-gość, do wyjaśniania struktur różnych kompleksów występujących w postaci agregatów, par jonowych czy układów zamkniętych. Jak sama nazwa wskazuje, NMR identyfikuje różne jądra w cząsteczkach (najczęściej proton ), mierząc ich przesunięcie chemiczne . Aktywność wiązania dwóch molekuł powoduje znaczną zmianę ich otoczenia elektronicznego. Prowadzi to do przesunięcia sygnałów w widmie NMR, a ta podstawowa zasada jest wykorzystywana do badania zjawisk chemii gospodarz-gość. Siły napędowe wiązania gospodarz-gość to różne wtórne interakcje między cząsteczkami, takie jak wiązania wodorowe i interakcje pi-pi . W związku z tym NMR służy również jako ważna technika do ustalenia obecności tych interakcji w kompleksie gospodarz-gość.
Poprzednie badania NMR dostarczyły przydatnych informacji na temat wiązania różnych gości z gospodarzami. Fox i in. obliczono interakcje wiązania wodorowe pomiędzy cząsteczkami pirydyny i poli (amido aminy (PAMAM) dendrymeru ; na podstawie przesunięcia chemicznego aminy o i amidowych . groups. W podobnym badaniu Xu et al miareczkowano metylu opiera G4 PAMAM dendrymeru ( gospodarza) z różnymi lekami na bazie amin (gości) i monitorowali chemiczne przesunięcia dendrymerów.W połączeniu z technikami 2D- NOESY NMR byli w stanie precyzyjnie zlokalizować położenie leków na dendrymerach i wpływ ich funkcjonalności na powinowactwo wiązania leków.Znaleźli przekonujące dowody na to, że cząsteczki leków kationowych przyczepiają się do powierzchni anionowych dendrymerów poprzez oddziaływania elektrostatyczne, podczas gdy lek anionowy lokalizuje się zarówno w rdzeniu, jak i na powierzchni dendrymerów, oraz że siła z tych oddziaływań zależą od wartości pKa cząsteczek.
W innym badaniu Sun i in. badali chemię gospodarz-gość cząsteczek rutenu trisbipirydylo-viologen z cucurbiturilem . Monitorując zmiany w chemicznych przesunięciach protonów pirydyny na wiogenie , odkryli, że tryby wiązania kompleksów 1:1 są zupełnie inne dla różnych cząsteczek kaburbiturilu.
Ważnym czynnikiem, o którym należy pamiętać podczas analizowania powiązania między gospodarzem a gościem, jest czas potrzebny na akwizycję danych w porównaniu do czasu zdarzenia powiązania. W wielu przypadkach zdarzenia wiązania są znacznie szybsze niż skala czasowa akwizycji danych, w którym to przypadku wyjściem jest uśredniony sygnał dla poszczególnych cząsteczek i kompleksu. Skala czasowa NMR jest rzędu milisekund, co w niektórych przypadkach, gdy reakcja wiązania jest szybka, ogranicza dokładność techniki.
Spektroskopia ultrafioletowo-widzialna
Spektroskopia ultrafioletowo-widzialna jest jedną z najstarszych i najszybszych metod badania aktywności wiązania różnych cząsteczek. Absorpcja światła UV odbywa się w skali czasowej pikosekund , dzięki czemu można obserwować poszczególne sygnały z gatunku. Jednocześnie intensywność absorpcji bezpośrednio koreluje ze stężeniem gatunku, co umożliwia łatwe obliczenie stałej asocjacji. Najczęściej albo gospodarz, albo gość jest przezroczysty dla światła UV, podczas gdy druga cząsteczka jest wrażliwa na promieniowanie UV. Zmiana stężenia cząsteczek wrażliwych na promieniowanie UV jest zatem monitorowana i dopasowywana do linii prostej przy użyciu metody Benesi-Hildebranda , z której można bezpośrednio obliczyć stałą asocjacji.
Uzyskuje się również dodatkowe informacje na temat stechiometrii kompleksów, ponieważ metoda Benesi-Hilderbranda zakłada stechiometrię 1:1 między gospodarzem a gościem. Dane dadzą linię prostą tylko wtedy, gdy tworzenie kompleksu ma również podobną stechiometrię 1:1. Niedawny przykład podobnych obliczeń został wykonany przez Sun i wsp., w którym miareczkowali cząsteczki rutenu trisbipirydylo-viologen dyniowatymi[7]urylami i wykreślili względną absorbancję cząsteczek dyniowatych jako funkcję ich całkowitego stężenia przy określonej długości fali. Dane dobrze pasowały do modelu wiązania 1:1 ze stałą wiązania wynoszącą .
Jako rozszerzenie można dopasować dane do różnych stechiometrii, aby zrozumieć kinetykę zdarzeń wiązania między gospodarzem a gościem. wykorzystali ten wniosek do nieznacznej modyfikacji konwencjonalnego wykresu Benesi-Hilderbranda, aby uzyskać porządek reakcji kompleksowania pomiędzy chiralnym, heterotrijądrowym kompleksem salenu Zn(II) zawierającym bar, zawierającym bar, z mostkiem heterotrinuklearnym salenu Zn(II ) z różnymi gośćmi imidazolami i estrami metylowymi aminokwasów, wraz z innymi parametrami. Miareczkowali ustalone stężenie kompleksu cynku z różnymi ilościami imidazoli i estrów metylowych, jednocześnie monitorując zmiany absorbancji pasma przejściowego pi-do-pi* przy 368 nm. Dane pasują do modelu, w którym stosunek gościa do gospodarza wynosi 2 w kompleksie. Następnie przeprowadzili te eksperymenty w różnych temperaturach, co umożliwiło im obliczenie różnych parametrów termodynamicznych przy użyciu równania van't Hoffa .
Kalorymetria miareczkowa izotermiczna
Techniki spektroskopowe dostarczają informacji o stałej wiązania i energii swobodnej Gibbsa , . Aby uzyskać pełny zestaw parametrów termodynamicznych, takich jak i , wymagana byłaby analiza van 't Hoffa przy użyciu równania van 't Hoffa . Jednak ostatnie postępy w technikach kalorymetrycznych pozwalają na pomiar i w jednym eksperymencie, umożliwiając tym samym określenie wszystkich parametrów termodynamicznych za pomocą równania:
pod warunkiem, że doświadczenie jest przeprowadzane w warunkach izotermicznych; stąd nazwa kalorymetria izotermiczna. Procedura jest podobna do konwencjonalnej procedury miareczkowania, w której gospodarz jest dodawany sekwencyjnie do gościa, a ciepło zaabsorbowane lub wydzielone jest mierzone w porównaniu z roztworem ślepym. Całkowite uwolnione ciepło Q odpowiada stałej asocjacji , a równanie:
Który można uprościć jako
Gdzie
- = Początkowe stężenie molowe żywiciela
- = Stężenie molowe gościa
- = objętość naczynia
Powyższe równanie może być rozwiązany za pomocą analizy regresji nieliniowej w celu uzyskania wartości i , a następnie i dla danej reakcji. Przewaga kalorymetrii izotermicznej nad innymi powszechnie stosowanymi technikami, poza podaniem całego zestawu parametrów termodynamicznych, polega na tym, że jest bardziej ogólna i nadaje się do szerokiego zakresu cząsteczek. Nie jest konieczne posiadanie związków z chromoforami lub widocznymi w promieniowaniu UV grupami funkcyjnymi w celu monitorowania procesu wiązania, ponieważ sygnał cieplny jest uniwersalną właściwością reakcji wiązania. Jednocześnie stosunek sygnału do szumu jest dość korzystny, co pozwala na dokładniejsze określenie stałych wiązania, nawet w bardzo rozrzedzonych warunkach. Niedawnym przykładem zastosowania tej techniki było badanie powinowactwa wiązania błony białkowej otaczającej Escherichia coli z kationami lipofilowymi stosowanymi w lekach w różnych środowiskach mimetycznych błon. Motywacją do powyższych badań było to, że błony te czynią bakterie opornymi na większość związków opartych na czwartorzędowym kationie amonowym , które mają działanie antybakteryjne. Zatem zrozumienie zjawiska wiązania umożliwiłoby projektowanie skutecznych antybiotyków dla E. coli . Naukowcy utrzymywali duży nadmiar ligandu nad białkiem, aby umożliwić zakończenie reakcji wiązania. Wykorzystując powyższe równania naukowcy przystąpili do obliczania , , oraz dla każdego leku w różnych środowiskach. Dane wskazywały, że stechiometria wiązania leku z błoną wynosiła 1:1 przy wartości mikromolowej . Ujemne wartości , i wskazują, że proces był zależny od entalpii przy wartości 8–12 kcal/mol dla każdego leku.
Aplikacje
Spektroskopia Ramana
Spektroskopia Ramana to technika spektroskopowa stosowana w badaniu cząsteczek, które wykazują efekt rozpraszania Ramana , gdy pada na nie światło monochromatyczne . Podstawowym wymogiem uzyskania sygnału Ramana jest to, że padające światło powoduje przejście elektronowe związku chemicznego ze stanu podstawowego do wirtualnego stanu energii, który po powrocie do stanu podstawowego wyemituje foton . Różnica energii pomiędzy fotonem pochłoniętym a wyemitowanym jest unikalna dla każdego związku chemicznego w zależności od jego środowiska elektronicznego. Dlatego technika ta służy jako ważne narzędzie do badania różnych zdarzeń wiązania, ponieważ wiązanie między cząsteczkami prawie zawsze powoduje zmianę ich środowiska elektronicznego. Jednak to, co sprawia, że spektroskopia ramanowska jest unikalną techniką, to fakt, że tylko przejścia, którym towarzyszy zmiana polaryzacji molekuły, są aktywne ramanowsko. Informacje strukturalne pochodzące z widm Ramana dostarczają bardzo konkretnych informacji o konfiguracji elektronowej kompleksu w porównaniu z poszczególnymi cząsteczkami gospodarza i gościa.
Spektroskopia Ramana w fazie roztworu często daje słaby przekrój rozpraszania. Dlatego też poczyniono ostatnie postępy w celu wzmocnienia sygnałów Ramana, takie jak spektroskopia Ramana wzmocniona powierzchniowo i rezonansowa spektroskopia Ramana . Takie techniki służą dodatkowemu celowi ilościowej oceny zdarzeń wiązania analit-receptor, dając bardziej szczegółowy obraz zjawisk kompleksowania gospodarz-gość tam, gdzie one faktycznie zachodzą, tj. w roztworach. W niedawnym przełomie Flood i in. określa siłę wiązania tetratiafulwalenem (TTF) i cyclobis parakwat (p-fenyleno) za pomocą spektroskopii Ramana oraz SER . Wcześniejsze prace w tej dziedzinie miały na celu dostarczenie informacji na temat wiązania i struktury powstałego kompleksu, a nie ilościowe pomiary siły stowarzyszenia. Naukowcy musieli użyć spektroskopii rezonansowej Ramana, aby móc uzyskać wykrywalne sygnały z roztworów o stężeniach tak niskich jak 1 mM. W szczególności skorelowali intensywność pasm Ramana z geometrią kompleksu w stanie fotowzbudnym. Podobnie jak w przypadku miareczkowania opartego na spektroskopii w świetle ultrafioletowym i widzialnym, obliczono stałą wiązania metodą „miareczkowania Ramana” i dopasowano krzywe wiązania do modeli 1:1, uzyskując -5,7 ± 0,6 kcal/mol. Badanie stanowi obecnie podstawę do podobnych badań dotyczących kompleksów z przeniesieniem ładunku w roztworach.
Współpraca
Współdziałanie definiuje się, gdy ligand wiąże się z receptorem z więcej niż jednym miejscem wiązania, a ligand powoduje zmniejszenie lub wzrost powinowactwa do wchodzących ligandów. Jeśli następuje wzrost wiązania kolejnych ligandów, uważa się to za pozytywną kooperację. Jeżeli obserwuje się spadek wiązania, to jest to kooperacja negatywna. Przykładami pozytywnej i negatywnej kooperacji są odpowiednio hemoglobina i receptor asparaginianowy.
W ostatnich latach badano termodynamiczne właściwości kooperatywności w celu określenia parametrów matematycznych, które odróżniają kooperatywność pozytywną lub negatywną. Tradycyjne równanie energii swobodnej Gibbsa stwierdza: . Jednak, aby określić ilościowo kooperatywność w systemie gospodarz-gość, należy wziąć pod uwagę energię wiązania. Schemat po prawej przedstawia wiązanie A, wiązanie B, pozytywne kooperatywne wiązanie A–B i wreszcie negatywne kooperatywne wiązanie A–B. Dlatego alternatywną postacią równania energii swobodnej Gibbsa byłaby
gdzie:
- = energia swobodna wiązania A
- = energia swobodna wiązania B
- = energia swobodna wiązania dla A i B na uwięzi
- = suma energii swobodnych wiązania
Uważa się, że jeśli więcej niż suma i , to pozytywnie współpracuje. Jeśli jest mniej, oznacza to negatywną współpracę. Chemia gospodarz-gość nie ogranicza się do interakcji receptor-ling i interakcji. Jest to również demonstrowane w systemach parowania jonów. W ostatnich latach takie interakcje są badane w środowisku wodnym z wykorzystaniem syntetycznych gospodarzy metaloorganicznych i organicznych cząsteczek gości. Na przykład, receptor polikationowy zawierający miedź (gospodarz) jest skoordynowany z cząsteczkami, takimi jak tetrakarboksylany, trikarbalan, asparaginian i octan (goście). Badanie to ilustruje, że to raczej entropia niż entalpia determinuje energię wiązania układu prowadzącą do negatywnej kooperacji. Duża zmiana entropii wynika z przemieszczenia cząsteczek rozpuszczalnika otaczających ligand i receptor. Kiedy wiele octanów wiąże się z receptorem, uwalnia do środowiska więcej cząsteczek wody niż tetrakarboksylan. Doprowadziło to do spadku energii swobodnej, co oznacza, że system współpracuje ujemnie. W podobnym badaniu, wykorzystującym gości guanidyniowych i Cu(II) oraz polikarboksylanowych, wykazano, że dodatnia kooperacja jest w dużej mierze zdeterminowana przez entalpię. Oprócz badań termodynamicznych chemia gospodarz-gość ma również zastosowania biologiczne.
Nadprzewodnictwo
Stwierdzono, że w niskich temperaturach i pod wysokim ciśnieniem bizmut wykazuje strukturę gospodarz-gość. To nieoczekiwanie prowadzi do silnego nadprzewodnictwa sprzęgającego.
Aplikacja biologiczna
Dendrymery w systemach dostarczania leków są przykładem różnych interakcji gospodarz-gość. Oddziaływanie między gospodarzem i gościem, odpowiednio dendrymerem i lekiem, może być hydrofobowe lub kowalencyjne. Oddziaływanie hydrofobowe między gospodarzem a gościem jest uważane za „kapsułkowane”, podczas gdy oddziaływania kowalencyjne uważa się za sprzężone. Wykazano, że zastosowanie dendrymerów w medycynie poprawia dostarczanie leku poprzez zwiększenie rozpuszczalności i biodostępności leku. W połączeniu, dendrymery mogą zwiększać zarówno wychwyt komórkowy, jak i zdolność celowania oraz zmniejszać lekooporność.
Rozpuszczalność różnych niesteroidowych leków przeciwzapalnych (NLPZ) wzrasta, gdy są one kapsułkowane w dendrymerach PAMAM. Badanie to pokazuje, że zwiększenie rozpuszczalności NLPZ wynika z oddziaływań elektrostatycznych między powierzchniowymi grupami aminowymi w PAMAM i grupami karboksylowymi występującymi w NLPZ. Do wzrostu rozpuszczalności przyczyniają się oddziaływania hydrofobowe między grupami aromatycznymi w lekach a wewnętrznymi wnękami dendrymeru. Gdy lek jest zamknięty w dendrymerze, jego właściwości fizyczne i fizjologiczne pozostają niezmienione, w tym niespecyficzność i toksyczność. Jednakże, gdy dendrymer i lek są ze sobą połączone kowalencyjnie, można go stosować do specyficznego ukierunkowania na tkankę i kontrolowanego uwalniania. Koniugacja kowalencyjna wielu leków na powierzchniach dendrymerów może stwarzać problem nierozpuszczalności.
Ta zasada jest również badana pod kątem zastosowania w leczeniu raka. Kilka grup ma kapsułkowane leki przeciwnowotworowe, takie jak: kamptotecyna , metotreksat i doksorubicyna . Wyniki tych badań wykazały, że dendrymery mają zwiększoną rozpuszczalność w wodzie, spowolnioną szybkość uwalniania i prawdopodobnie kontrolują cytotoksyczność leków. Cisplatyna została skoniugowana z dendrymerami PAMAM, co dało takie same wyniki farmakologiczne, jak wymienione powyżej, ale koniugacja pomogła również w akumulacji cisplatyny w guzach litych po podaniu dożylnym.
Wyczuwanie
Tradycyjnie do wykrywania chemicznego podchodzi się za pomocą systemu, który zawiera kowalencyjnie związany wskaźnik z receptorem przez łącznik. Gdy analit zwiąże się, wskaźnik zmienia kolor lub fluoryzuje. Ta technika nazywana jest podejściem wskaźnik-przerywnik-receptor (ISR). W przeciwieństwie do ISR, test przemieszczenia wskaźnika (IDA) wykorzystuje niekowalencyjne oddziaływanie między receptorem (gospodarz), wskaźnikiem i analitem (gość). Podobnie jak ISR, IDA wykorzystuje również wskaźniki kolorymetryczne (C-IDA) i fluorescencyjne (F-IDA). W teście IDA receptor jest inkubowany ze wskaźnikiem. Po dodaniu analitu do mieszaniny wskaźnik jest uwalniany do środowiska. Po uwolnieniu wskaźnik zmienia kolor (C-IDA) lub fluoryzuje (F-IDA).
IDA oferuje kilka zalet w porównaniu z tradycyjnym podejściem do wykrywania substancji chemicznych ISR. Po pierwsze, nie wymaga, aby wskaźnik był kowalencyjnie związany z receptorem. Po drugie, ponieważ nie ma wiązania kowalencyjnego, różne wskaźniki mogą być używane z tym samym receptorem. Wreszcie, pożywki, w których można zastosować test, są zróżnicowane.
Techniki wykrywania chemicznego, takie jak C-IDA, mają implikacje biologiczne. Na przykład protamina jest koagulantem, który jest rutynowo podawany po operacji sercowo-płucnej, która przeciwdziała przeciwzakrzepowemu działaniu herapiny. W celu ilościowego oznaczenia protaminy w próbkach osocza stosuje się kolorymetryczny test przemieszczenia. Błękit Barwnik jest niebieski, gdy jest niezwiązany, ale gdy jest związany z herapiną, ma kolor fioletowy. Wiązanie między Azure A i heparyną jest słabe i odwracalne. To pozwala protaminie wypierać Azure A. Po uwolnieniu barwnik ma fioletowy kolor. Stopień przemieszczenia barwnika jest proporcjonalny do ilości protaminy w osoczu.
F-IDA została wykorzystana przez Kwalczykowskiego i współpracowników do monitorowania aktywności helikazy w E.coli . W tym badaniu jako wskaźnik użyli oranżu tiazolowego. Helikaza rozwija dsDNA, tworząc ssDNA. Intensywność fluorescencji oranżu tiazolowego ma większe powinowactwo do dsDNA niż ssDNA, a jego intensywność fluorescencji wzrasta, gdy jest związany z dsDNA, niż gdy jest niezwiązany.
Przełączanie konformacyjne
Krystalicznego ciała stałego jest tradycyjnie uważane za statycznej jednostki w których przemieszczanie jej elementów atomowych ograniczony do jego drgań równowagi. Jak widać z przemiany grafitu w diament, przemiana ciała stałego w ciało stałe może zachodzić pod ciśnieniem fizycznym lub chemicznym. Ostatnio zaproponowano, że przekształcenie jednego układu kryształów w inny zachodzi w sposób kooperatywny. Większość z tych badań skupiała się na badaniu struktury organicznej lub metaloorganicznej. Oprócz badań wielkocząsteczkowych przemian krystalicznych prowadzone są również badania cząsteczek monokryształów, które mogą zmieniać swoją konformację w obecności rozpuszczalników organicznych. Wykazano, że kompleks metaloorganiczny zmienia się w różne orientacje w zależności od tego, czy jest wystawiony na działanie oparów rozpuszczalnika, czy nie.
Zastosowania środowiskowe
Systemy gościa hosta zostały wykorzystane do usunięcia niebezpiecznych materiałów ze środowiska. Mogą być wykonane w różnych rozmiarach i różnych kształtach, aby uwięzić różnych chemicznych gości. Jednym z zastosowań jest zdolność p-tert-butykaliksu[4]arenu do wychwytywania jonów cezu. Cez-137 jest radioaktywny i istnieje potrzeba skutecznego usuwania go z odpadów promieniotwórczych. Chemia gospodarz-gość była również wykorzystywana do usuwania rakotwórczych amin aromatycznych i ich pochodnych N-nitrozowych z wody. Te materiały odpadowe są wykorzystywane w wielu procesach przemysłowych i znajdują się w różnych produktach, takich jak: pestycydy, leki i kosmetyki.



![{\ Displaystyle K_ {a} ^ {\ ominus} = {\ Frac {\ {HG \}} {\ {H \} \ {G \}}} = {\ Frac {[HG]} {[H][ G]}}\times \Gamma }](https://wikimedia.org/api/rest_v1/media/math/render/svg/9754da7964a0bf1e4808d376020a6e8e25c207f8)
![{\ Displaystyle [HG]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/80fdda7af86666fc9f3342541e225ac292bb9a81)
![{\ Displaystyle [H]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/59d2226487b5eb5f8a607d7233b5825b05775db6)
![{\ Displaystyle [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3b230fd410e2cd9ecc472bb1de122c0b523f561c)

![{\ Displaystyle K_ {a} = {\ Frac {[HG]} {[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae235e284e33c2c110956324a712e6c6962507e0)





![{\ Displaystyle K = {\ Frac {[HG]}{[H][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f0699f3a1a1574661940baea1c8bbfb4a3136447)
![{\ Displaystyle T_ {H} = [H] + K [H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4ef4c10eece3b96f87a168ce59d82e54e4c5d249)
![{\ Displaystyle T_ {G} = [G] + K [H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/1246c000c420a8e140e2ef3450c8ed780b7eea5b)


![{\ Displaystyle [H] = T_ {H}-T_ {G} + [G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4cab49660f203c07b5f2b895ab2f8c1545cbbd8c)
![{\displaystyle [HG]=K[H][G]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e88c585a975e89e21c0933648c84b4fdedd50c12)





















![{\ Displaystyle \ beta _ {pq} = {\ Frac {[H_ {p} G_ {q}]} {[H] ^ {p} [G] ^ {q}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/db509ff939d1eb629ba6b10c11abc7b380a95c76)
![{\ Displaystyle T_ {H} = [H] + \ suma p \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e85683a8e3d63267f6160f59ea79b76f9f87ba74)
![{\ Displaystyle T_ {G} = [G] + \ suma q \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/515652e9c3e3cd95a67682abf6e924937de71da8)
![{\ Displaystyle [H_ {p} G_ {q}] = \ beta _ {pq} [H] ^ {p} [G] ^ {q}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ae16c12c4b85d02e4add18af69d42131945ce0e8)














![{\ Displaystyle Q = {V \ Delta H_ {0}[HG]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/05741345df5c805bd41d52801bd5df273f77089c)
![{\ Displaystyle Q = {\ Frac {V \ Delta H_ {0}K_ {a} [H_ {0}][ G] {1 + K_ {a} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/68c72903aa7b75076ad27a613a05847bfcc18e9e)
![{\displaystyle [H_{0}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b09a9868564ad3a8fc85cbdf4abab3df406316f8)













