Heksakarbonyl wanadu - Vanadium hexacarbonyl
|
|
| Nazwy | |
|---|---|
|
Nazwa IUPAC
heksakarbonylwanad (0)
|
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| ChEBI | |
| Karta informacyjna ECHA |
100.039.928 |
|
PubChem CID
|
|
| UNII | |
|
|
| Nieruchomości | |
| C 6 O 6 V. | |
| Masa cząsteczkowa | 219,00 g / mol |
| Wygląd | niebiesko-zielone kryształy żółte roztwory |
| Gęstość | 1,7 g / cm 3 |
| Temperatura topnienia | rozkłada się |
| Temperatura wrzenia | sublimuje w temperaturze 50 ° C (122 ° F; 323 K) (15 mmHg) |
| nierozpuszczalny | |
| Rozpuszczalność w innych rozpuszczalnikach | 5 g / l heksanu ; lepiej rozpuszczalny w dichlorometanie |
| Struktura | |
| rombowe | |
| ośmiościenny | |
| 0 D | |
| Zagrożenia | |
| Główne zagrożenia | Źródło CO |
| Związki pokrewne | |
|
Związki pokrewne
|
Cr (CO) 6 , VCI 3 |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Referencje Infobox | |
Heksakarbonyl wanadu jest związkiem nieorganicznym o wzorze V (CO) 6 . Jest to niebiesko-czarne lotne ciało stałe. Ten wysoce reaktywny gatunek jest godny uwagi z teoretycznego punktu widzenia jako rzadki, możliwy do wyodrębnienia homoleptyczny karbonyl metalu, który jest paramagnetyczny. Większość gatunków o wzorze M x (CO) y postępuje zgodnie z regułą 18 elektronów , podczas gdy V (CO) 6 ma 17 elektronów walencyjnych.
Synteza
Tradycyjnie V (CO) 6 jest przygotowywany w dwóch etapach za pośrednictwem V (CO) -
6 . W pierwszym etapie, VCL 3 redukuje się za pomocą metalicznego sodu poniżej 200 atm CO w temperaturze 160 ° C. Rozpuszczalnikiem do tej redukcji jest zazwyczaj diglym , CH 3 OCH 2 CH 2 OCH 2 CH 2 OCH 3 . Ten tri eteru rozpuszcza sole sodowe, podobnie do zachowania z eteru koronowego :
- 4 Na + VCl 3 + 6 CO + 2 diglyme → [Na (diglyme) 2 ] [V (CO) 6 ] + 3 NaCl
Powstały anion utlenia się kwasem:
- 2 V (CO) -
6 + 2 H 3 PO 4 → 2 V (CO) 6 + H 2 + 2 H
2 PO -
4
Reakcje
Heksakarbonyl wanadu jest nietrwały termicznie. Jego podstawową reakcją jest redukcja do monoanionu V (CO) -
6 których sole są dobrze zbadane. Jest również podatny na podstawienie przez trzeciorzędowe ligandy fosfinowe , co często prowadzi do dysproporcjonowania .
V (CO) 6 reaguje ze źródłami anionu cyklopentadienylowego, dając pomarańczowy kompleks czworonożnego stolca fortepianu (C 5 H 5 ) V (CO) 4 (tt 136 ° C). Podobnie jak wiele związków metaloorganicznych o obojętnym ładunku, ten pół-warstwowy gatunek jest lotny. W pierwotnym preparacie tego gatunku jako źródło C zastosowano C 5 H 5 HgCl
5 H. -
5 .
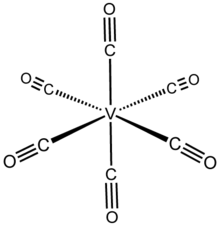
Struktura
V (CO) 6 przyjmuje oktaedryczną geometrię koordynacyjną i jest izostrukturalny z heksakarbonylem chromu , mimo że mają różne liczby elektronów walencyjnych. Krystalografia rentgenowska o wysokiej rozdzielczości wskazuje, że cząsteczka jest nieznacznie zniekształcona przy dwóch ( osiowych ) krótszych odległościach V – C 1,993 (2) A w porównaniu z czterema (równikowymi) 2,005 (2) Å. Mimo że V (−I) jest jonem większym niż V (0), odległości V – C w V (CO) -
6 są o 0,07 Å krótsze niż w neutralnym prekursorze.
Bibliografia
Dalsza lektura
- Oryginalna synteza: Ercoli, R .; Calderazzo, F .; Alberola, A. (1960). „Synteza heksakarbonylu wanadu”. J. Am. Chem. Soc . 81 : 2966–2967. doi : 10.1021 / ja01496a073 .
