2-butanol - 2-Butanol

|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Butan-2-ol |
|
| Inne nazwy
s -butanol
s alkohol Butylowy 2-butanol 2-butylowy alkohol |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 773649 1718764 ( R ) |
|
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| Karta informacyjna ECHA |
100.001.053 |
| Numer WE | |
| 1686 396584 ( R ) |
|
| Siatka | 2-butanol |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 1120 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 4 H 10 O | |
| Masa cząsteczkowa | 74,123 g·mol -1 |
| Gęstość | 0,808 g cm- 3 − |
| Temperatura topnienia | -115 °C; -175°F; 158 tys |
| Temperatura wrzenia | 98 do 100°C; 208 do 212 ° F; 371 do 373 tys |
| 290g/L | |
| log P | 0,683 |
| Ciśnienie pary | 1,67 kPa (przy 20 °C) |
| Kwasowość (p K a ) | 17,6 |
| -5,7683 × 10 -5 cm 3 mol -1 | |
|
Współczynnik załamania ( n D )
|
1,3978 (przy 20°C) |
| Termochemia | |
|
Pojemność cieplna ( C )
|
197,1 J K -1 mol -1 |
|
Standardowa
entropia molowa ( S |
213,1 J K -1 mol -1 |
|
Standardowa entalpia
tworzenia (Δ f H ⦵ 298 ) |
-343,3 do -342,1 kJ mol -1 mol |
|
Standardowa entalpia
spalania (Δ c H ⦵ 298 ) |
-2,6611 do -2,6601 MJ mol -1 |
| Zagrożenia | |
| Arkusz danych dotyczących bezpieczeństwa | inchem.org |
| Piktogramy GHS |
 
|
| Hasło ostrzegawcze GHS | Ostrzeżenie |
| H226 , H319 , H335 , H336 | |
| P261 , P305+351+338 | |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | 22 do 27 ° C (72 do 81 ° F; 295 do 300 K) |
| 405 ° C (761 ° F; 678 K) | |
| Granice wybuchowości | 1,7-9,8% |
| Dawka lub stężenie śmiertelne (LD, LC): | |
|
LC Lo ( najniższa opublikowana )
|
16 000 ppm (szczur, 4 godz.) 10 670 ppm (mysz, 3,75 godz.) 16 000 ppm (mysz, 2,67 godz.) |
| NIOSH (limity ekspozycji dla zdrowia w USA): | |
|
PEL (dopuszczalne)
|
TWA 150 ppm (450 mg/m 3 ) |
|
REL (zalecane)
|
TWA 100 ppm (305 mg/m 3 ) ST 150 ppm (455 mg/m 3 ) |
|
IDLH (Bezpośrednie niebezpieczeństwo)
|
2000 ppm |
| Związki pokrewne | |
|
Powiązane butanole
|
n -Butanol Izobutanol tert -Butanol |
|
Związki pokrewne
|
Butanon |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
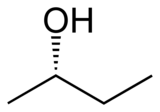
2-butanol lub sec -butanolu , jest związkiem organicznym o wzorze C H 3 CH ( O H) CH 2 CH 3 . Ten drugorzędowy alkohol jest łatwopalną, bezbarwną cieczą, która jest rozpuszczalna w trzech częściach wody i całkowicie miesza się z rozpuszczalnikami organicznymi. Produkowany jest na dużą skalę, przede wszystkim jako prekursor przemysłowego rozpuszczalnika ketonu metylowo-etylowego . 2-Butanol jest chiralny i dlatego może być otrzymany jako jeden z dwóch stereoizomerów oznaczonych jako ( R )-(-)-2-butanol i ( S )-(+)-2-butanol. Zwykle występuje jako mieszanina dwóch stereoizomerów 1:1 — mieszanina racemiczna .
 |
|
 |

|
| ( R )-(−)-2-butanol | ( S )-(+)-2-butanol |
Produkcja i aplikacje
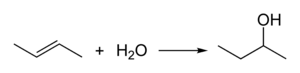
2-butanolu produkowany przemysłowo przez uwodnienie z 1-butenu i 2-butenu :
Jako katalizator tej konwersji stosuje się kwas siarkowy .
W laboratorium można go wytworzyć w reakcji Grignarda w reakcji bromku etylomagnezu z aldehydem octowym w wysuszonym eterze dietylowym lub tetrahydrofuranie .
Chociaż jako rozpuszczalnik stosuje się pewien 2-butanol, jest on głównie przekształcany w butanon (keton metylowo-etylowy, MEK), ważny rozpuszczalnik przemysłowy, występujący w wielu domowych środkach czyszczących i zmywaczach do farb. Chociaż większość zmywaczy przestała używać MEK w swoich produktach z powodu problemów zdrowotnych i nowych przepisów. Lotne estry 2-butanolu mają przyjemny aromat i są stosowane w niewielkich ilościach jako perfumy lub w sztucznych aromatach.
Rozpuszczalność
Wymieniona rozpuszczalność 2-butanolu jest często nieprawidłowa, w tym niektóre z najbardziej znanych odnośników, takich jak Indeks Merck , CRC Handbook of Chemistry and Physics , oraz Lange's Handbook of Chemistry . Nawet Międzynarodowy Program Bezpieczeństwa Chemicznego wymienia niewłaściwą rozpuszczalność. Ten powszechny błąd powstał z powodu Handbuch der Organischen Chemie Beilsteina ( Podręcznik Chemii Organicznej ). Ta praca przytacza fałszywą rozpuszczalność 12,5 g/100 g wody. Wiele innych źródeł wykorzystywało tę rozpuszczalność, która przekształciła się w powszechny błąd w świecie przemysłowym. Prawidłowe dane (35,0 g/100 g w 20 °C, 29 g/100 g w 25 °C i 22 g/100 g w 30 °C) zostały po raz pierwszy opublikowane w 1886 r. przez Alexejewa, a następnie podobne dane podali inni naukowcy, w tym Dołgolenko i Dryer odpowiednio w 1907 i 1913 roku.
Środki ostrożności
Podobnie jak inne butanole, 2-butanol ma niską toksyczność ostrą. LD 50 wynosi 4400 mg / kg (szczura doustnie).
Doniesiono o kilku eksplozjach podczas konwencjonalnej destylacji 2-butanolu, najwyraźniej z powodu nagromadzenia nadtlenków o temperaturze wrzenia wyższej niż czysty alkohol (a zatem koncentracja w naczyniu destylacyjnym podczas destylacji). Ponieważ alkohole, w przeciwieństwie do eterów, nie są powszechnie znane jako zdolne do tworzenia zanieczyszczeń nadtlenkowych, niebezpieczeństwo prawdopodobnie zostanie przeoczone. 2-butanol należy do substancji chemicznych tworzących nadtlenek klasy B
Bibliografia
Linki zewnętrzne
- Międzynarodowa Karta Bezpieczeństwa Chemicznego 0112
- Kieszonkowy przewodnik NIOSH dotyczący zagrożeń chemicznych. „#0077” . Narodowy Instytut Bezpieczeństwa i Higieny Pracy (NIOSH).
- Kryteria zdrowia środowiskowego IPCS 65: Butanole: cztery izomery
- Przewodnik BHP IPCS 4: 2-butanol