Oddziaływania glikan-białko - Glycan-protein interactions
Oddziaływania glikan-białko reprezentują klasę oddziaływań biomolekularnych, które występują między wolnymi lub związanymi z białkami glikanami a ich pokrewnymi partnerami wiążącymi. Interakcje wewnątrzcząsteczkowe glikan-białko (białko-glikan) zachodzą między glikanami a białkami, do których są one kowalencyjnie przyłączone. Wraz z interakcjami białko-białko tworzą one mechanistyczną podstawę dla wielu istotnych procesów komórkowych , zwłaszcza dla interakcji komórka-komórka oraz interakcji między komórkami gospodarza. Na przykład SARS-CoV-2 , czynnik sprawczy COVID-19 , wykorzystuje swoje ekstensywnie glikozylowane białko wypustek (S) do wiązania się z receptorem ACE2 , umożliwiając mu wnikanie do komórek gospodarza. Białko kolce jest strukturą trimeryczną , a każda podjednostka zawiera 22 miejsca N-glikozylacji, co czyni je atrakcyjnym celem do poszukiwania szczepionek .
Glikany, ogólna nazwa dla monosacharydów i oligosacharydów , stanowią jedną z głównych modyfikacji potranslacyjnych z białek przyczyniających się do ogromnej złożoności biologicznego życia. Rzeczywiście, trzy różne heksozy mogą teoretycznie wytwarzać od 1056 do 27 648 unikalnych trisacharydów w przeciwieństwie do tylko 6 peptydów lub oligonukleotydów utworzonych odpowiednio z 3 aminokwasów lub 3 nukleotydów . W przeciwieństwie do opartej na szablonie biosyntezy białek , „język” glikozylacji jest wciąż nieznany, co sprawia, że glikobiologia jest gorącym tematem aktualnych badań, biorąc pod uwagę ich występowanie w organizmach żywych.
Badanie oddziaływań glikan-białko dostarcza wglądu w mechanizmy sygnalizacji komórkowej i pozwala stworzyć narzędzia do lepszego diagnozowania wielu chorób, w tym raka . Rzeczywiście, nie ma znanych typów raka, które nie obejmują nieregularnych wzorców glikozylacji białek .
Termodynamika wiązania
Wiązanie białek wiążących glikan (GBP) z glikanami można modelować za pomocą prostej równowagi . Oznaczając glikany jako i białka jako :
Ze związanym stałej równowagi o
Który jest przearanżowany, aby uzyskać stałą dysocjacji zgodnie z konwencjami biochemicznymi:
Biorąc pod uwagę, że wiele GBP wykazuje wielowartościowość, model ten można rozszerzyć, aby uwzględnić wiele równowag:
Oznaczający skumulowaną równowagę wiązania z ligandami jako
Z odpowiednią stałą równowagi:
A zapis bilansu materiałowego dla białka ( oznacza całkowitą koncentrację białka):
Wyrażając warunki za pomocą stałej równowagi, otrzymujemy ostateczny wynik:
Stężenie wolnego białka wynosi zatem:
Jeśli , tj. istnieje tylko jedna domena receptora węglowodanowego, równanie redukuje się do
Wraz ze wzrostem stężenia wolnego białka spada; stąd też pozorne maleje.
Wiązanie z pierścieniami aromatycznymi
Intuicja chemiczna sugeruje, że miejsca wiązania glikanów mogą być wzbogacone w polarne reszty aminokwasowe, które tworzą interakcje niekowalencyjne , takie jak wiązania wodorowe , z polarnymi węglowodanami. Rzeczywiście, analiza statystyczna kieszeni wiążących węglowodany pokazuje, że reszty kwasu asparaginowego i asparaginy są obecne dwa razy częściej, niż można by to przewidzieć przypadkowo. Co zaskakujące, istnieje jeszcze silniejsza preferencja dla aminokwasów aromatycznych : tryptofan ma 9-krotny wzrost częstości, tyrozyna 3-krotny, a histydyna 2-krotny. Wykazano, że zasadniczą siłą jest oddziaływanie między układem aromatycznym a węglowodanem, jak pokazano na Rysunku 1 . Interakcji zidentyfikowane jeśli °, przy odległości (odległość od celu ) jest mniejsza niż 4.5A.
Efekty stereochemii
Ta interakcja silnie zależy od stereochemii w węglowodanów cząsteczki. Rozważmy na przykład górną ( ) i dolną ( ) powierzchnię -D-Glukoza i -D-Galaktoza . Wykazano, że pojedyncza zmiana w stereochemii przy węglu C4 przesuwa preferencję reszt aromatycznych z boku (2,7-krotna preferencja dla glukozy) na bok (14-krotna preferencja dla galaktozy).
Efekty elektroniki
Porównanie elektrostatycznych potencjałów powierzchniowych (ESP) pierścieni aromatycznych w tryptofanie , tyrozynie , fenyloalaniny i histydynie sugeruje, że efekty elektronowe również odgrywają rolę w wiązaniu z glikanami (patrz Figura 2 ). Po znormalizowaniu gęstości elektronów dla pola powierzchni tryptofan nadal pozostaje najbardziej bogatym w elektrony akceptorem oddziaływań, co sugeruje możliwą przyczynę jego 9-krotnej częstości występowania w kieszeniach wiążących węglowodany. Ogólnie rzecz biorąc, mapy potencjału elektrostatycznego podążają za trendem rozpowszechnienia .
Partnerzy wiążący węglowodany
Istnieje wiele białek zdolnych do wiązania się z glikanami, w tym lektyny , przeciwciała , adhezyny drobnoustrojów , aglutyniny wirusowe itp.
Lektyny
Lektyny to ogólna nazwa białek z domenami rozpoznającymi węglowodany (CRD). Chociaż stał się prawie synonimem białek wiążących glikan, nie obejmuje przeciwciał, które również należą do tej klasy.
Lektyny znajdujące się w komórkach roślin i grzybów są szeroko stosowane w badaniach jako narzędzie do wykrywania, oczyszczania i analizy glikanów. Jednak użyteczne lektyny mają zwykle suboptymalną specyfikę . Na przykład aglutynina-1 Ulex europaeus (UEA-1), lektyna ekstrahowana z roślin, zdolna do wiązania się z antygenem ludzkiej krwi typu O , może również wiązać się z niepowiązanymi glikanami, takimi jak 2'-fukozylolaktoza, GalNAcα1-4(Fucα1-2) Galβ1-4GlcNAc i antygen Lewis-Y .
Przeciwciała
Chociaż przeciwciała wykazują nanomolarne powinowactwo do antygenów białkowych, specyficzność wobec glikanów jest bardzo ograniczona. W rzeczywistości dostępne przeciwciała mogą wiązać tylko <4% z 7000 antygenów glikanów ssaków; ponadto większość z tych przeciwciał ma niskie powinowactwo i wykazuje reaktywność krzyżową.
Lambodia
W przeciwieństwie do kręgowców szczękowych, których odporność opiera się na zmiennych, zróżnicowanych i łączących się segmentach genów (VDJ) immunoglobulin , bezkręgowce bezszczękowe , takie jak minóg i śluzica , tworzą różnorodność receptorów poprzez rearanżację somatycznego DNA powtórzeń bogatych w leucynę (LRR). moduły, które są włączone w geny *vlr* (zmienne receptory leukocytów). Te LRR tworzą trójwymiarowe struktury przypominające zakrzywione solenoidy, które selektywnie wiążą określone glikany.
Badania University of Maryland, wykazały, że przeciwciała minóg (lambodies) może wybiórczo wiązać się guza antigen antygeny węglowodanowe (takich jak Mn i TF ) z powinowactwem nanomolowych. Antygen T-nouvelle (Tn) i TF są obecne w białkach aż w 90% różnych komórek nowotworowych po modyfikacji potranslacyjnej , podczas gdy w zdrowych komórkach antygeny te są znacznie bardziej złożone. Dzięki selekcji lambodów, które mogą wiązać się z aGPA , ludzką glikoproteiną błony erytrocytów , pokrytą 16 ugrupowaniami TF , poprzez sortowanie komórek aktywowane magnetycznie (MACS) i sortowanie komórek aktywowane fluorescencyjnie (FACS) uzyskano bogate w leucynę lambody VLRB. aGPA.23 . Ta lambody barwiła selektywnie (nad zdrowymi próbkami) komórki z 14 różnych typów gruczolakoraków : pęcherza moczowego , przełyku , jajnika , języka , policzków, szyjki macicy , wątroby , nosa, nosogardła , sieci większej, okrężnicy , piersi , krtani i płuc . Ponadto pacjenci, których tkanki wybarwiły się dodatnio za pomocą VLRB.aGPA.23, mieli znacznie mniejszy wskaźnik przeżycia.
Bliższe spojrzenie na strukturę krystaliczną VLRB.aGPA.23 ujawnia resztę tryptofanu w pozycji 187 tuż nad kieszenią wiążącą węglowodany.
Wielowartościowość w strukturze
Wiele białek wiążących glikan (GBP) jest oligomerycznych i zazwyczaj zawiera wiele miejsc wiązania glikanów (zwanych również domenami rozpoznawania węglowodanów). Zdolność do tworzenia wielowartościowych oddziaływań białko- ligand znacznie zwiększa siłę wiązania: podczas gdy wartości dla poszczególnych oddziaływań CRD-glikan mogą mieścić się w zakresie mM, ogólne powinowactwo GBP do glikanów może osiągać zakresy nanomolowe, a nawet pikomolowe . Ogólna siła oddziaływań jest opisywana jako awidność (w przeciwieństwie do powinowactwa, które opisuje pojedynczą równowagę). Czasami chciwość jest również nazywana pozorną, aby podkreślić nierównowagowy charakter interakcji.
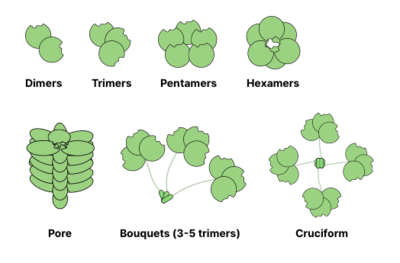
Poniżej przedstawiono typowe struktury oligomeryzacji lektyn . Na przykład galektyny są zwykle obserwowane jako dimery, podczas gdy intelektyny tworzą trimery, a pentraksyny łączą się w pentamery. Większe struktury, takie jak heksameryczne białka Reg , mogą łączyć się w pory penetrujące błonę. Kolektyny mogą tworzyć jeszcze dziwniejsze kompleksy: bukiety trimerów czy nawet struktury przypominające krzyże (np. w SP-D ).
Obecne badania
Biorąc pod uwagę znaczenie oddziaływań glikan-białko, trwają badania poświęcone a) stworzeniu nowych narzędzi do wykrywania oddziaływań glikan-białko oraz b) wykorzystaniu tych narzędzi do rozszyfrowania tzw. kodu cukrowego.
Macierze glikanów
Jednym z najczęściej używanych narzędzi do badania interakcji glikan-białko są macierze glikanów . Macierz glikanów to zazwyczaj szkiełka aktywowane NHS lub żywicą epoksydową, na których nadrukowano różne glikany za pomocą drukowania zrobotyzowanego. Te dostępne w handlu macierze mogą zawierać do 600 różnych glikanów, których specyficzność została szeroko zbadana.
Oddziaływania glikan-białko można wykryć testując białka będące przedmiotem zainteresowania (lub ich biblioteki ), które posiadają znaczniki fluorescencyjne . Strukturę białka wiążącego glikan można rozszyfrować kilkoma metodami analitycznymi opartymi na spektrometrii masowej , w tym MALDI-MS , LC-MS , tandem MS-MS i/lub 2D NMR .
Badania oparte na bioinformatyce
Zastosowano metody obliczeniowe do poszukiwania parametrów (np. skłonność do reszt, hydrofobowość, płaskość), które mogłyby odróżnić białka wiążące glikan od innych obszarów powierzchniowych. Na przykład model wyszkolony na 19 niehomologicznych strukturach wiążących węglowodany był w stanie przewidzieć domeny wiążące węglowodany (CRD) z dokładnością 65% dla struktur nieenzymatycznych i 87% dla enzymatycznych. Dalsze badania wykorzystały obliczenia energii Van der Waalsa oddziaływań białko-sonda i skłonności aminokwasów do identyfikacji CRD o 98% specyficzności przy 73% czułości . Nowsze metody mogą przewidywać CRD nawet na podstawie sekwencji białkowych , porównując sekwencję z tymi, których struktury są już znane.
Kod cukru
W przeciwieństwie do badań nad białkami, gdzie pierwotna struktura białka jest jednoznacznie zdefiniowana przez sekwencję nukleotydów ( kod genetyczny ), glikobiologia nadal nie może wyjaśnić, w jaki sposób pewna „wiadomość” jest kodowana za pomocą węglowodanów lub jak jest „odczytywana” i „przekładana”. " przez inne jednostki biologiczne.
Interdyscyplinarny wysiłek, łączący chemię, biologię i biochemię, bada interakcje glikan-białko, aby zobaczyć, jak różne sekwencje węglowodanów inicjują różne odpowiedzi komórkowe.





![{\ Displaystyle K_ {a} = {\ Frac {[PG]}{[P][G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/38c58e2be67844c3537babb4f86e1ca38a60d94b)

![{\ Displaystyle K_ {d} = {\ Frac {[P][G]}{[PG]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/72976d7d2ea5a25b59b79f62a8f778c4c3bac42b)






![{\ Displaystyle \ beta _ {i} = {\ Frac {[PG_ {i}]} {[P][G] ^ {i}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/9153a83607a00bc4eb96cdf6928a07a2024f1bdd)

![{\ Displaystyle c_ {P} = [P] + [PG] + \ kropki + [PG_ {n}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/e1cabed41f72e76cf6c1a5e2886153b4bbdfebdc)
![{\ Displaystyle c_ {P} = [P] (1 + \ beta _ {1} [G] + \ kropki + \ beta _ {n} [G] ^ {n}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d4101827e4dd349b92d1d5aaa3260881cfd76654)
![{\ Displaystyle [P] = {\ Frac {c_ {P}} {1 + \ suma _ {i = 1} ^ {n} {\ beta _ {i} [G] ^ {i}}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/5e5a5b4f3769c0ca0996d6d56e9fe287f3690918)

![{\ Displaystyle [P] = {\ Frac {C_ {P}} {1 + \ beta _ {1} [G]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b617d194d337f431f73fc11a407538b873b5d8de)