Magnetochemia - Magnetochemistry
Magnetochemia zajmuje się właściwościami magnetycznymi związków chemicznych . Właściwości magnetyczne wynikają ze spinu i orbitalnego momentu pędu elektronów zawartych w związku. Związki są diamagnetyczne, gdy nie zawierają niesparowanych elektronów . Związki molekularne zawierające jeden lub więcej niesparowanych elektronów są paramagnetyczne . Wielkość paramagnetyzmu wyraża się jako efektywny moment magnetyczny μ eff . W przypadku metali przejściowych pierwszego rzędu wielkość μ eff jest, w pierwszym przybliżeniu, prostą funkcją liczby niesparowanych elektronów, wzorem zawierającym tylko spin. Ogólnie rzecz biorąc, sprzężenie spin-orbita powoduje, że μ eff odbiega od wzoru zawierającego tylko spin. W przypadku cięższych metali przejściowych, lantanowców i aktynowców , nie można pominąć sprzężenia spinowo-orbitalnego. Interakcja wymienna może zachodzić w klastrach i nieskończonych sieciach, co skutkuje ferromagnetyzmem , antyferromagnetyzmem lub ferrimagnetyzmem w zależności od względnych orientacji poszczególnych spinów.
Podatność magnetyczna
Podstawowym pomiarem w magnetochemii jest podatność magnetyczna. Mierzy siłę oddziaływania po umieszczeniu substancji w polu magnetycznym. Objętość podatność magnetyczna , reprezentowany przez symbol jest określony przez zależność
gdzie jest namagnesowaniem materiału ( magnetycznym momentem dipolowym na jednostkę objętości), mierzonym w amperach na metr ( jednostki SI ) i jest natężeniem pola magnetycznego , również mierzonym w amperach na metr. Podatność jest wielkością bezwymiarową . Dla zastosowań chemicznych korzystną wielkością jest molowa podatność magnetyczna (χ mol ). Jest mierzony wm 3 ·mol -1 (SI) lub cm 3 ·mol -1 (CGS) i jest definiowany jako
gdzie ρ jest gęstością w kg·m- 3 (SI) lub g·cm- 3 (CGS), a M jest masą molową w kg·mol- 1 (SI) lub g·mol- 1 (CGS).
Dostępnych jest wiele metod pomiaru podatności magnetycznej.
- W wadze Gouy zmiana masy próbki jest mierzona wagą analityczną, gdy próbka jest umieszczona w jednorodnym polu magnetycznym. Pomiary są kalibrowane względem znanego standardu, takiego jak tiocyjanian kobaltu rtęciowego, HgCo(NCS) 4 . Kalibracja eliminuje potrzebę znajomości gęstości próbki. Pomiary zmiennej temperatury można wykonać umieszczając próbkę w kriostacie pomiędzy nabiegunnikami magnesu.
- Bilans Evans . to waga skrętna, która wykorzystuje próbkę w stałej pozycji i zmienny magnes wtórny, aby przywrócić magnesy do ich początkowej pozycji. On również jest kalibrowany względem HgCo(NCS) 4 .
- W wadze Faradaya próbkę umieszcza się w polu magnetycznym o stałym nachyleniu i waży na wadze skrętnej. Ta metoda może dostarczyć informacji o anizotropii magnetycznej .
- SQUID to bardzo czuły magnetometr.
- W przypadku substancji w roztworze do pomiaru podatności można zastosować NMR .
Rodzaje zachowań magnetycznych
Gdy izolowany atom zostanie umieszczony w polu magnetycznym, dochodzi do interakcji, ponieważ każdy elektron w atomie zachowuje się jak magnes, to znaczy elektron ma moment magnetyczny . Istnieją dwa rodzaje interakcji.
- Diamagnetyzm. Po umieszczeniu w polu magnetycznym atom staje się spolaryzowany magnetycznie, to znaczy wytwarza indukowany moment magnetyczny. Siła oddziaływania ma tendencję do wypychania atomu z pola magnetycznego. Zgodnie z konwencją podatność diamagnetyczna otrzymuje znak ujemny. Bardzo często atomy diamagnetyczne nie mają niesparowanych elektronów, tzn. każdy elektron jest sparowany z innym elektronem na tym samym orbicie atomowej . Momenty dwóch elektronów znoszą się wzajemnie, więc atom nie ma netto momentu magnetycznego. Jednak w przypadku jonu Eu 3+, który ma sześć niesparowanych elektronów, orbitalny moment pędu anuluje moment pędu elektronu, a jon ten jest diamagnetyczny przy zerowym kelwinie.
- Paramagnetyzm. Przynajmniej jeden elektron nie jest sparowany z innym. Atom ma stały moment magnetyczny. Po umieszczeniu w polu magnetycznym atom jest przyciągany do tego pola. Zgodnie z konwencją podatność paramagnetyczna otrzymuje znak dodatni.
Gdy atom jest obecny w związku chemicznym, jego zachowanie magnetyczne jest modyfikowane przez środowisko chemiczne. Pomiar momentu magnetycznego może dostarczyć przydatnych informacji chemicznych.
W niektórych materiałach krystalicznych poszczególne momenty magnetyczne mogą być wyrównane względem siebie (moment magnetyczny ma zarówno wielkość, jak i kierunek). Daje to początek ferromagnetyzmowi , antyferromagnetyzmowi lub ferrimagnetyzmowi . Są to właściwości kryształu jako całości, mające niewielki wpływ na właściwości chemiczne.
Diamagnetyzm
Diamagnetyzm jest uniwersalną właściwością związków chemicznych, ponieważ wszystkie związki chemiczne zawierają pary elektronów. Mówi się, że związek, w którym nie ma niesparowanych elektronów, jest diamagnetyczny. Efekt jest słaby, ponieważ zależy od wielkości indukowanego momentu magnetycznego. Zależy to od liczby par elektronów i chemicznej natury atomów, do których należą. Oznacza to, że efekty są addytywne i można zestawić tabelę „wkładów diamagnetycznych”, czyli stałych Pascala . W przypadku związków paramagnetycznych obserwowaną podatność można skorygować dodając do niej tzw. poprawkę diamagnetyczną, czyli podatność diamagnetyczną obliczoną z wartości z tabeli.
Paramagnetyzm
Mechanizm i zależność temperaturowa
Najprostszą ilustracją mechanizmu paramagnetyzmu jest jon metalu z pojedynczym niesparowanym elektronem, takim jak Cu 2+ , w kompleksie koordynacyjnym. Poszczególne jony metali są utrzymywane daleko od siebie przez ligandy, tak że nie ma między nimi interakcji magnetycznych. Mówi się, że system jest magnetycznie rozrzedzony. Dipole magnetyczne atomów wskazują losowe kierunki. Po przyłożeniu pola magnetycznego następuje rozszczepienie Zeemana pierwszego rzędu . Atomy o spinach wyrównanych do pola nieznacznie przewyższają liczebnie atomy o spinach nieukierunkowanych. W efekcie Zeemana pierwszego rzędu różnica energii między dwoma stanami jest proporcjonalna do zastosowanego natężenia pola. Oznaczając różnicę energii jako Δ E , rozkład Boltzmanna daje stosunek dwóch populacji jako , gdzie k jest stałą Boltzmanna , a T jest temperaturą w kelwinach . W większości przypadków Δ E jest znacznie mniejsze niż kT i wykładniczy można rozszerzyć do 1 – Δ E/kT . Z obecności 1/ T w tym wyrażeniu wynika, że podatność jest odwrotnie proporcjonalna do temperatury.
Jest to znane jako prawo Curie , a stała proporcjonalności C , jest znana jako stała Curie , której wartość dla podatności molowej oblicza się jako
gdzie N to stała Avogadro , g to współczynnik g Landego , a μ B to magneton Bohra . W zabiegu tym założono, że stan podstawowy elektronu nie jest zdegenerowany, podatność magnetyczna wynika wyłącznie z spinu elektronu i tylko stan podstawowy jest zaludniony termicznie.
Podczas gdy niektóre substancje podlegają prawu Curie, inne podlegają prawu Curie-Weissa .
T C jest temperatura Curie . Prawo Curie-Weissa będzie miało zastosowanie tylko wtedy, gdy temperatura będzie znacznie wyższa od temperatury Curie. W temperaturach poniżej temperatury Curie substancja może stać się ferromagnetyczna . Bardziej skomplikowane zachowanie obserwuje się przy cięższych elementach przejściowych.
Efektywny moment magnetyczny
Gdy przestrzegane jest prawo Curie, iloczyn podatności molowej i temperatury jest stały. Skuteczny moment magnetyczny , μ eff jest definiowana jako
Gdzie C ma jednostki CGS cm 3 mol -1 K, μ eff to
Gdzie C ma jednostki SI m 3 mol -1 K, μ eff to
Wielkość μeff jest faktycznie bezwymiarowa, ale często jest podawana w jednostkach magnetonu Bohra (μ B ).
W przypadku substancji zgodnych z prawem Curie efektywny moment magnetyczny jest niezależny od temperatury. W przypadku innych substancji μ eff zależy od temperatury, ale zależność ta jest niewielka, jeśli obowiązuje prawo Curie-Weissa i temperatura Curie jest niska.
Paramagnetyzm niezależny od temperatury
Związki, które mają być diamagnetyczne, mogą wykazywać ten rodzaj słabego paramagnetyzmu. Wynika to z efektu Zeemana drugiego rzędu, w którym występuje dodatkowe rozszczepienie, proporcjonalne do kwadratu natężenia pola. Trudno to zaobserwować, ponieważ związek nieuchronnie oddziałuje również z polem magnetycznym w sensie diamagnetycznym. Niemniej jednak dostępne są dane dotyczące jonu nadmanganianowego . Łatwiej jest zaobserwować w związkach cięższych pierwiastków, takich jak związki uranylowe .
Interakcje giełdowe
Oddziaływania wymienne występują, gdy substancja nie jest magnetycznie rozcieńczona i występują oddziaływania między poszczególnymi ośrodkami magnetycznymi. Jednym z najprostszych układów wykazujących wyniki oddziaływań wymiennych jest krystaliczny octan miedzi(II) , Cu 2 (OAc) 4 (H 2 O) 2 . Jak wskazuje wzór zawiera dwa jony miedzi(II). Jony Cu 2+ są utrzymywane razem przez cztery ligandy octanowe, z których każdy wiąże się z obydwoma jonami miedzi. Każdy jon Cu 2+ ma konfigurację elektronową ad 9 , a więc powinien mieć jeden niesparowany elektron. Gdyby istniało wiązanie kowalencyjne między jonami miedzi, elektrony sparowałyby się i związek byłby diamagnetyczny. Zamiast tego zachodzi interakcja wymienna, w której spiny niesparowanych elektronów częściowo się do siebie wyrównają. W rzeczywistości powstają dwa stany, jeden z spinami równoległymi, a drugi z spinami przeciwnymi. Różnica energii między tymi dwoma stanami jest tak mała, że ich populacje różnią się znacznie w zależności od temperatury. W konsekwencji moment magnetyczny zmienia się wraz z temperaturą w sposób sigmoidalny . Stan z przeciwstawnymi spinami ma niższą energię, więc oddziaływanie można w tym przypadku zaklasyfikować jako antyferromagnetyczne. Uważa się, że jest to przykład nadwymiany , w której pośredniczą atomy tlenu i węgla ligandów octanowych. Inne dimery i klastry wykazują zachowanie wymiany.
Interakcje wymienne mogą oddziaływać na nieskończone łańcuchy w jednym wymiarze, płaszczyzny w dwóch wymiarach lub na cały kryształ w trzech wymiarach. Są to przykłady dalekosiężnego porządkowania magnetycznego. Dają one początek ferromagnetyzmowi , antyferromagnetyzmowi lub ferrimagnetyzmowi , w zależności od charakteru i względnych orientacji poszczególnych spinów.
Związki w temperaturach poniżej temperatury Curie wykazują dalekosiężny porządek magnetyczny w postaci ferromagnetyzmu. Inną krytyczną temperaturą jest temperatura Neela , poniżej której występuje antyferromagnetyzm. Sześciowodzian chlorku niklu, NiCl 2 · 6 H 2 O, ma temperaturę Néel wynoszącą 8,3 K. W tej temperaturze podatność jest maksymalna. Poniżej temperatury Néela podatność maleje, a substancja staje się antyferromagnetyczna.
Kompleksy jonów metali przejściowych
Efektywny moment magnetyczny dla związku zawierającego jon metalu przejściowego z jednym lub większą liczbą niesparowanych elektronów zależy odpowiednio od całkowitego orbitalnego i spinowego momentu pędu niesparowanych elektronów i . „Całkowita” w tym kontekście oznacza „ suma wektorów ”. W przybliżeniu, że stany elektronowe jonów metali są określone przez sprzężenie Russella-Saundersa i że sprzężenie spin-orbita jest zaniedbywalne, moment magnetyczny jest podany przez
Formuła tylko spinowa
Orbitalny moment pędu jest generowany, gdy elektron znajdujący się na orbicie zdegenerowanego zestawu orbitali zostaje przesunięty na inny orbital w zestawie przez obrót. W zespołach o małej symetrii pewne obroty nie są możliwe. W takim przypadku mówi się, że orbitalny moment pędu jest „wygaszony” i jest mniejszy niż można by się spodziewać (częściowe wygaszenie) lub zero (całkowite wygaszenie). W następujących przypadkach następuje całkowite wygaszenie. Zauważ, że elektron w zdegenerowanej parze orbitali d x 2 –y 2 lub d z 2 nie może obracać się na drugim orbicie ze względu na symetrię.
Wygaszony orbitalny moment pędu d n Oktaedry Czworościenny wysokoobrotowy niskoobrotowy d 1 e 1 d 2 e 2 d 3 t 2g 3 d 4 T 2 g 3 E g 1 d 5 T 2 g 3 E g 2 d 6 t 2g 6 e 3 t 2 3 d 7 t 2g 6 e g 1 e 4 t 2 3 d 8 t 2g 6 e g 2 d 9 t 2g 6 e g 3
- legenda: t 2g , t 2 = (d xy , d xz , d yz ). e g , e = (d x 2 –y 2 , d z 2 ).
Kiedy orbitalny moment pędu jest całkowicie wygaszony, a paramagnetyzm można przypisać wyłącznie spinowi elektronu. Całkowity spinowy moment pędu jest po prostu o połowę mniejszy niż liczba niesparowanych elektronów i wynika z tego formuła uwzględniająca tylko spin.
gdzie n jest liczbą niesparowanych elektronów. Formuła tylko spinowa jest dobrym pierwszym przybliżeniem dla wysokospinowych kompleksów metali przejściowych pierwszego rzędu .
Jon Liczba
niesparowanych
elektronów
Moment tylko spinowy /μ Bobserwowany
moment /μ BTi 3+ 1 1,73 1,73 V 4+ 1 1,73 1,68–1,78 Cu 2+ 1 1,73 1,70–2,20 V 3+ 2 2.83 2,75–2,85 Ni 2+ 2 2.83 2,8–3,5 V 2+ 3 3,87 3,80–3,90 Cr 3+ 3 3,87 3,70–3,90 Co 2+ 3 3,87 4,3–5,0 Mn 4+ 3 3,87 3,80–4,0 cr 2+ 4 4,90 4,75–4,90 Fe 2+ 4 4,90 5,1-5,7 Mn 2+ 5 5,92 5,65–6,10 Fe 3+ 5 5,92 5,7-6,0
Niewielkie odchylenia od wzoru tylko spinowego mogą wynikać z zaniedbania orbitalnego momentu pędu lub sprzężenia spinowo-orbitalnego. Na przykład tetraedryczne kompleksy d 3 , d 4 , d 8 i d 9 mają tendencję do wykazywania większych odchyleń od wzoru tylko spinu niż oktaedryczne kompleksy tego samego jonu, ponieważ „wygaszanie” wkładu orbitalnego jest mniej skuteczne w przypadku tetraedrycznym .
Kompleksy niskospinowe
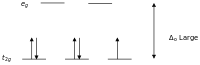
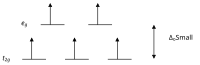
Zgodnie z teorią pola krystalicznego, orbitale d jonu metalu przejściowego w kompleksie oktaedalnym są podzielone na dwie grupy w polu krystalicznym. Jeśli rozszczepienie jest wystarczająco duże, aby pokonać energię potrzebną do umieszczenia elektronów na tym samym orbicie o przeciwnym spinie, powstanie kompleks o niskim spinie.
Wysoko i nisko-spinowe kompleksy oktaedryczne liczba-d Liczba niesparowanych elektronów przykłady wysokoobrotowy niskoobrotowy d 4 4 2 Cr 2+ , Mn 3+ d 5 5 1 Mn 2+ , Fe 3+ d 6 4 0 Fe 2+ , Co 3+ d 7 3 1 Co 2+
Z jeden niesparowany elektron μ eff wartości w zakresie od 1,8 do 2,5 ľ B i dwoma niesparowanych elektronów zakres wynosi od 3,18 do 3,3 ľ B . Zauważ, że niskospinowe kompleksy Fe 2+ i Co 3+ są diamagnetyczne. Inna grupa kompleksów, które są diamagnetyczny płaskiej kwadratowej kompleksy d 8 jonów, takich jak Ni 2+ i Rh + i Au 3+ .
Zakręć cross-over
Kiedy różnica energii między stanami wysokospinowym i niskospinowym jest porównywalna do kT (k jest stałą Boltzmanna, a T temperaturą), między stanami spinowymi ustala się równowaga, obejmująca tak zwane „elektroniczne izomery”. Tris dithiocarbamato żelaza (III), Fe (S 2 CNR 2 ) 3 , jest dobrze udokumentowane przykład. Efektywny moment, różni się od typowych d 5 niskiej wartości wirowania 2,25 ľ B w 80 K do ponad 4 ľ B powyżej 300 K.
metale przejściowe drugiego i trzeciego rzędu
Rozszczepianie pola krystalicznego jest większe w przypadku kompleksów cięższych metali przejściowych niż w przypadku metali przejściowych omówionych powyżej. Konsekwencją tego jest to, że kompleksy niskospinowe są znacznie częstsze. Stałe sprzężenia spin-orbita, ζ, są również większe i nie można ich zignorować, nawet w elementarnych zabiegach. Zachowanie magnetyczne zostało podsumowane, jak poniżej, wraz z obszerną tabelą danych.
liczba-d kT/ζ=0,1
μ effkT/ζ=0
μ effZachowanie z dużą stałą sprzężenia spinowo-orbity ζ ND d 1 0,63 0 μ eff zmienia się wraz z T 1/2 d 2 1,55 1,22 μ eff zmienia się z T, w przybliżeniu d 3 3.88 3.88 Niezależnie od temperatury d 4 2,64 0 μ eff zmienia się wraz z T 1/2 d 5 1,95 1,73 μ eff zmienia się z T, w przybliżeniu
Lantanowce i aktynowce
Sprzężenie Russella-Saundersa, sprzężenie LS, dotyczy jonów lantanowców, efekty pola krystalicznego można zignorować, ale sprzężenie spin-orbita nie jest pomijalne. W konsekwencji spin i orbitalny moment pędu muszą być połączone
a obliczony moment magnetyczny jest podany przez
Właściwości magnetyczne trójwartościowych związków lantanowców lantanowiec Ce Pr Nd Po południu Sm Eu Bóg Tb Dy Ho Er Tm Yb Lu Liczba niesparowanych elektronów 1 2 3 4 5 6 7 6 5 4 3 2 1 0 obliczony moment /μ B 2,54 3,58 3.62 2,68 0,85 0 7,94 9,72 10,65 10,6 9.58 7,56 4,54 0 obserwowany moment /μ B 2,3–2,5 3,4–3,6 3,5-3,6 1,4–1,7 3,3–3,5 7,9–8,0 9,5–9,8 10,4–10,6 10,4–10,7 9,4–9,6 7,1–7,5 4,3–4,9 0
W aktynowcach sprzężenie spin-orbita jest silne i zbliża się do sprzężenia j j .
Oznacza to, że trudno jest obliczyć moment efektywny. Na przykład, uranu (IV), F 2 , w złożonym ucl [ 6 ] 2- zawiera odmierzoną skuteczny moment 2,2 ľ B , który zawiera wkład z niezależne od temperatury paramagnetycznych.
Pierwiastki grupy głównej i związki organiczne organic

Bardzo niewiele związków pierwiastków grupy głównej jest paramagnetycznych. Godne uwagi przykłady obejmują: tlen , O 2 ; tlenek azotu , NO; dwutlenek azotu , NO 2 i dwutlenek chloru , ClO 2 . W chemii organicznej mówi się, że związki z niesparowanym elektronem są wolnymi rodnikami . Wolne rodniki, z pewnymi wyjątkami, są krótkotrwałe, ponieważ jeden wolny rodnik będzie szybko reagował z drugim, więc ich właściwości magnetyczne są trudne do zbadania. Jeśli jednak rodniki są dobrze oddzielone od siebie w rozcieńczonym roztworze w stałej matrycy, w niskiej temperaturze, można je badać za pomocą elektronowego rezonansu paramagnetycznego (EPR). Takie rodniki są generowane przez napromieniowanie. Obszerne badania EPR ujawniły wiele na temat delokalizacji elektronów w wolnych rodnikach. Symulowane widmo rodnika CH 3 • wykazuje rozszczepienie nadsubtelne w wyniku oddziaływania elektronu z 3 równoważnymi jądrami wodoru, z których każdy ma spin 1/2.
Etykiety spinowe to długowieczne wolne rodniki, które można wstawić do cząsteczek organicznych, aby można je było badać za pomocą EPR. Na przykład, nitroxide MTSL , funkcjonalna pochodna tlenku TEtra metylopiperydyny, TEMPO , jest stosowana w ukierunkowanym znakowaniu spinu .
Aplikacje
Gadolinu jon Gd 3+ , posiada f 7 konfiguracji elektronowej, przy czym wszystkie obraca równoległe. Związki jonu Gd 3+ są najbardziej odpowiednie do zastosowania jako środek kontrastowy w skanach MRI . Momenty magnetyczne związków gadolinu są większe niż momenty dowolnego jonu metalu przejściowego. Gadolin jest preferowany w stosunku do innych jonów lantanowców, z których niektóre mają większe momenty efektywne, ze względu na niezdegenerowany stan podstawowy elektronów .
Przez wiele lat natura oksyhemoglobiny Hb-O 2 była bardzo kontrowersyjna. Stwierdzono eksperymentalnie, że jest diamagnetyczny. Deoksy-hemoglobina jest powszechnie uznaje się kompleks żelaza w +2 stopniu utlenienia , czyli ad 6 system o wysokiej spinowego momentu magnetycznego najbliższej wartości spinu tylko 4,9 ľ B . Zaproponowano, że żelazo jest utleniane, a tlen redukowany do ponadtlenku.
- Fe(II)Hb (wysokospinowy) + O 2 ⇌ [Fe(III)Hb]O 2 −
Następnie zaproponowano, aby łączenie w pary elektronów Fe 3+ i O 2 − odbywało się poprzez mechanizm wymiany. Obecnie wykazano, że w rzeczywistości żelazo(II) zmienia się z wysokospinowego na niskospinowy, gdy cząsteczka tlenu przekazuje parę elektronów żelazu. Podczas gdy w dezoksyhemoglobinie atom żelaza leży powyżej płaszczyzny hemu, w kompleksie niskospinowym efektywny promień jonowy jest zmniejszony, a atom żelaza leży w płaszczyźnie hemu.
- Fe(II)Hb + O 2 ⇌ [Fe(II)Hb]O 2 (niskospinowy)
Informacje te mają istotny wpływ na badania nad znalezieniem sztucznych nośników tlenu .
Związki galu(II) były nieznane do niedawna. Ponieważ liczba atomowa galu jest liczbą nieparzystą (31), Ga 2+ powinien mieć niesparowany elektron. Założono, że będzie działał jako wolny rodnik i będzie miał bardzo krótki czas życia. Nieistnienie związków Ga(II) było częścią tak zwanego efektu pary obojętnych . Gdy zsyntetyzowano sole anionu o wzorze empirycznym, takie jak [GaCl 3 ] − , okazało się, że są one diamagnetyczne. To implikowało utworzenie wiązania Ga-Ga i dimerycznego wzoru, [Ga 2 Cl 6 ] 2− .
Zobacz też
- Mineralogia magnetyczna
- Magnetoelektrochemia
- Magnetyczna ciecz jonowa
- Wiruj lód
- Obróć szkło
- Superdiamagnetyzm , superparamagnetyzm , superferromagnetyzm
- Magnetyzm jednocząsteczkowy
Bibliografia
Bibliografia
- Carlin, RL (1986). Magnetochemia . Springer . Numer ISBN 978-3-540-15816-5.
- Earnshaw, Alan (1968). Wprowadzenie do magnetochemii . Prasa akademicka .
- Figgis, BN; Lewis, J. (1960). „Magnochemia związków złożonych”. W Lewisie. J. i Wilkinsa. RG (red.). Nowoczesna Chemia Koordynacyjna . Nowy Jork: Wiley .
- Greenwood, Norman N .; Earnshaw, Alan (1997). Chemia pierwiastków (wyd. 2). Butterworth-Heinemann . Numer ISBN 978-0-08-037941-8.
- Sad, AF (2003). Magnetochemia . Podkłady chemiczne Oxford. Wydawnictwo Uniwersytetu Oksfordzkiego . Numer ISBN 0-19-879278-6.
- Selwood, PW (1943). Magnetochemia . Interscience Publishers Inc.
- Vulfson, Siergiej (1998). Magnetochemia molekularna . Taylor i Franciszek . Numer ISBN 90-5699-535-9.