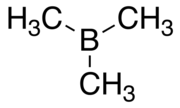
Trimetyloboran - Trimethylborane
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
trimetyloboran |
|||
| Inne nazwy
Trimetyloborin
Trimetyloboron |
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.008.926 |
||
| Numer WE | |||
|
Identyfikator klienta PubChem
|
|||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 9 B | |||
| Masa cząsteczkowa | 55,92 g/mol | ||
| Wygląd zewnętrzny | Bezbarwny gaz lub ciecz | ||
| Gęstość | 0,625 g / cm 3 w temperaturze od -100 ° C | ||
| Temperatura topnienia | -161,5 ° C (-258,7 ° F; 111,6 K) | ||
| Temperatura wrzenia | -20,2 ° C (-4,4 ° F; 253,0 K) | ||
| Niewielka, bardzo reaktywna | |||
| Struktura | |||
| Δ | |||
| Zagrożenia | |||
| Główne zagrożenia | Samorzutnie palny w powietrzu; powoduje oparzenia | ||
| Piktogramy GHS |
  
|
||
| Hasło ostrzegawcze GHS | Zagrożenie | ||
| H220 , H250 , H280 , H314 | |||
| P210 , P222 , P260 , P264 , P280 , P301+330+331 , P302+334 , P303+361+353 , P304+340 , P305+351+338 , P310 , P321 , P363 , P370+378 , P377 , P381 , P403 , P405 , P410 + 403 , P422 , P501 | |||
| Temperatura zapłonu | Nie dotyczy, gaz piroforyczny | ||
| -40 ° C (-40 ° F; 233 K) | |||
| Związki pokrewne | |||
|
Związki pokrewne
|
|||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Trimetyloboran (TMB) jest toksyczny samozapalnym gazem o wzorze B (CH 3 ) 3 (która może być również jako Mn 3 B, a Me reprezentujących metyl ).
Nieruchomości
Jako płyn jest bezbarwny. Najsilniejsza linia w widmie podczerwonym znajduje się przy 1330 cm- 1, a następnie linie przy 3010 cm- 1 i 1185 cm- 1 .
Jego temperatura topnienia wynosi -161,5 ° C, a jego temperatura wrzenia -20,2 ° C.
Ciśnienie pary jest przez log P = 6,1385 + 1,75 log T - 1393.3 / T - 0.007735 T , gdzie T jest temperaturą w stopniach Kelvina . Masa cząsteczkowa to 55,914. Ciepło parowania wynosi 25,6 kJ/mol.
Przygotowanie
Trimetyloboran został po raz pierwszy opisany w 1862 roku przez Edwarda Franklanda , który również wspomniał o jego adduktie z amoniakiem. Ze względu na jego niebezpieczny charakter, związek ten nie był już badany aż do 1921 r., kiedy Alfred Stock i Friedrich Zeidler wykorzystali reakcję między gazowym trichlorkiem boru a dimetylocynkiem . Chociaż substancję można przygotować przy użyciu odczynników Grignarda, wyjście jest zanieczyszczone przez niepożądane produkty z rozpuszczalnika. Trimetyloboran można wytworzyć na małą skalę z 98% wydajnością w reakcji trimetyloglinu w heksanie z tribromkiem boru w eterze dibutylowym jako rozpuszczalniku. Jeszcze inne metody to poddanie reakcji boranu tributylu z chlorkiem trimetyloglinu lub tetrafluoroboranu potasu z trimetyloglinem. Jeszcze inną metodą jest dodanie trifluorku boru w eterze do jodku metylomagnezowego .
Reakcje
Trimetyloboran samorzutnie zapala się w powietrzu, jeśli stężenie jest wystarczająco wysokie. Pali się zielonym płomieniem wytwarzając sadzę. Wolniejsze utlenianie tlenem w rozpuszczalniku lub w fazie gazowej może prowadzić do powstania dimetylotrioksadiboralanu, który zawiera pierścień składający się z dwóch atomów boru i trzech atomów tlenu. Jednak głównym produktem jest nadtlenek dimetyloborylometylu, który szybko rozkłada się do dimetoksymetyloboranu.
Trimetyloboran jest silnym kwasem Lewisa . B (CH 3 ) 3 może stanowić addukt z amoniakiem : (NH 3 ): B (CH 3 ) 3 . jak również inne bazy Lewisa. Właściwości kwasu Lewisa, B (CH 3 ) 3 zostały przeanalizowane przez modelu ECW otrzymując E A = 2,90 C i A = 3,60. Gdy trimetyloboran tworzy addukt z trimetyloaminą , powstaje steryczne odpychanie między grupami metylowymi na B i N. Model ECW może zapewnić miarę tego efektu sterycznego.
Trimetyloboran reaguje z wodą i chlorem w temperaturze pokojowej. Reaguje również ze smarem, ale nie z teflonem czy szkłem.
Trimetyloboran reaguje z diboranem, nieproporcjonalne do formy monomethyldiborane i dimethyldiborane (CH 3 ) BH 2 .BH 3 i (CH 3 ) 2 BH.BH 3 .
Reaguje jako gaz z trimetylofosfiną, tworząc stałą sól Lewisa z ciepłem tworzenia -41 kcal na mol. Ten addukt ma ciepło sublimacji -24,6 kcal/mol. Nie zachodzi reakcja z trimetyloarsyną lub trimetylostybiną .
Metylolit reakcji z trimetyloboran wytwarza tetramethylborate sól: LiB (CH 3 ) 4 . Jon tetrametyloboranowy ma ładunek ujemny i jest izoelektroniczny z neopentanem , tetrametylosilanem i kationem tetrametyloamoniowym .
Posługiwać się
Trimetyloboran był używany jako licznik neutronów. Do tego celu musi być bardzo czysty. Jest również stosowany do chemicznego osadzania z fazy gazowej, gdzie bor i węgiel muszą być osadzane razem.