Tiazol - Thiazole
|
|
|||
|
|
|||
| Nazwy | |||
|---|---|---|---|
|
Preferowana nazwa IUPAC
1,3-tiazol |
|||
| Inne nazwy
Tiazol
|
|||
| Identyfikatory | |||
|
Model 3D ( JSmol )
|
|||
| CZEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Karta informacyjna ECHA |
100.005.475 |
||
|
Identyfikator klienta PubChem
|
|||
| UNII | |||
|
Pulpit nawigacyjny CompTox ( EPA )
|
|||
|
|||
|
|||
| Nieruchomości | |||
| C 3 H 3 N S | |||
| Masa cząsteczkowa | 85,12 g·mol -1 | ||
| Temperatura wrzenia | 116 do 118 °C (241 do 244 °F; 389 do 391 K) | ||
| Kwasowość (p K a ) | 2,5 (kwas sprzężonego) | ||
| -50,55 x 10 -6 cm 3 / mol | |||
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|||
|
|
|||
| Referencje do infoboksu | |||
Tiazol , lub 1,3-tiazol , jest związkiem heterocyklicznym, który zawiera zarówno siarkę, jak i azot; termin „tiazol” odnosi się również do dużej rodziny pochodnych. Sam tiazol jest bladożółtą cieczą o zapachu podobnym do pirydyny i wzorze cząsteczkowym C 3 H 3 NS. Pierścień tiazolowy jest godny uwagi jako składnik witaminy tiaminy (B 1 ).
Struktura molekularna i elektronowa
Tiazole są członkami azoli , heterocykli, które obejmują imidazole i oksazole. Tiazol można również uznać za grupę funkcyjną . Oksazole są związkami pokrewnymi, z siarką zastąpioną tlenem. Tiazole są strukturalnie podobne do imidazoli , z tiazolową siarką zastąpioną azotem.
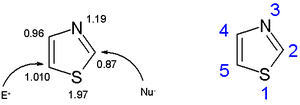
Pierścienie tiazolowe są płaskie i aromatyczne . Tiazole charakteryzują się większą delokalizacją elektronów pi niż odpowiadające im oksazole i dlatego mają większą aromatyczność . O tej aromatyczności świadczy chemiczne przesunięcie protonów pierścienia w spektroskopii protonowej NMR (między 7,27 a 8,77 ppm), wyraźnie wskazujące na silny diamagnetyczny prąd pierścieniowy . Obliczona gęstość elektronów pi oznacza C5 jako pierwotne miejsce podstawienia elektrofilowego i C2 jako miejsce podstawienia nukleofilowego.
Występowanie tiazoli i soli tiazoliowych
Tiazole występują w wielu specjalistycznych produktach, często połączonych z pochodnymi benzenu, tzw. benzotiazolami. Oprócz witaminy B 1 , pierścień tiazolowy znajduje się epotilonu . Innymi ważnymi pochodnymi tiazolu są benzotiazole , na przykład lucyferyna, chemiczna świetlik . Podczas gdy tiazole są dobrze reprezentowane w biocząsteczkach , oksazole nie. Występuje w naturalnie występujących peptydach i jest wykorzystywany w rozwoju peptydomimetyków (tj. cząsteczek naśladujących funkcję i strukturę peptydów).
Tiazole o znaczeniu handlowym obejmują głównie barwniki i fungicydy . Tifluzamid, tricyklazol i tiabendazol są sprzedawane do zwalczania różnych szkodników rolniczych. Inną szeroko stosowaną pochodną tiazolu jest niesteroidowy lek przeciwzapalny Meloxicam . Następujące barwniki antrochinonowe zawierają podjednostki benzotiazolu: Algol Yellow 8 (CAS# [6451-12-3]), Algol Yellow GC (CAS# [129-09-9]), Indanthren Rubine B (CAS# [6371-49-9] ]), Indanthren Blue CLG (nr CAS [6371-50-2] i Indanthren Blue CLB (nr CAS [6492-78-0]). Te barwniki tiazolowe są używane do barwienia bawełny .
Synteza organiczna
Istnieją różne laboratoryjne metody syntezy organicznej tiazoli. Widoczna jest synteza tiazolu Hantzscha, która jest reakcją między haloketonami i tioamidami . Na przykład 2,4-dimetylotiazol jest syntetyzowany z tioacetamidu i chloroacetonu . Kolejny przykład podano poniżej:
- W adaptacji syntezy Robinsona- Gabriela 2- acylaminoketony reagują z pięciosiarczkiem fosforu .
- W syntezie Cooka-Heilbrona α- aminonitryl reaguje z dwusiarczkiem węgla .
- Niektóre tiazole można uzyskać poprzez zastosowanie reakcji Herza .
Biosynteza
Tiazole powstają na ogół w reakcjach cysteiny , która stanowi szkielet pierścienia NCCS. Tiamina nie pasuje jednak do tego wzorca. Kilka szlaków biosyntezy prowadzi do pierścienia tiazolowego, wymaganego do tworzenia tiaminy. Siarka tiazolu pochodzi z cysteiny. W bakteriach beztlenowych grupa CN pochodzi od dehydroglicyny.
Reakcje
O pK a 2,5 dla kwasu koniugatu tiazole o wiele mniej zasadowy niż imidazol (pKa = 7).
Deprotonacja w C2: ładunek ujemny w tej pozycji jest stabilizowany jako ylid ; Zasady Hausera i związki litoorganiczne reagują w tym miejscu, zastępując proton
- 2-(trimetylosililo)tiazol (z grupą trimetylosililową w pozycji 2) jest stabilnym substytutem i reaguje z szeregiem elektrofilów, takich jak aldehydy , halogenki acylu i keteny
- Elektrofilowe podstawienie aromatyczne w C5 wymaga grup aktywujących, takich jak grupa metylowa w tym bromowaniu :
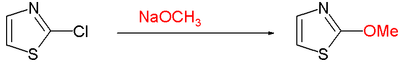
- Nukleofilowe podstawienie aromatyczne często wymaga grupy opuszczającej, takiej jak chlor w C2 z
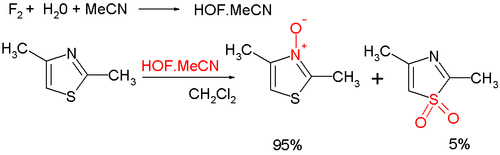
- Utlenianie organiczne przy azocie daje aromatyczny N- tlenek tiazolu ; istnieje wiele środków utleniających, takich jak mCPBA ; nowym jest kwas podfluorowy otrzymany z fluoru i wody w acetonitrylu ; część utleniania zachodzi przy siarce, prowadząc do niearomatycznego sulfotlenku / sulfonu :
- Tiazole są formyl syntony ; konwersja R-tia do R-CHO aldehydu odbywa się, odpowiednio, jodek metylu ( N -methylation) redukcję organicznych z borowodorkiem sodowym i hydrolizę z chlorku rtęci (II) w wodzie.
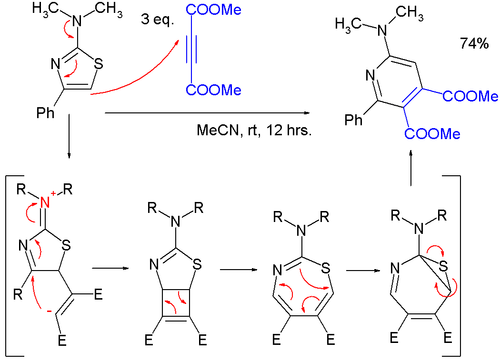
- Tiazole mogą reagować w cykloaddycjach , ale na ogół w wysokich temperaturach ze względu na korzystną stabilizację aromatyczną reagenta; Po reakcjach Dielsa-Aldera z alkinami następuje wytłaczanie siarki, a produktem końcowym jest pirydyna ; w jednym z badań stwierdzono, że bardzo łagodna reakcja 2-(dimetyloamino)tiazolu z acetylenodikarboksylanem dimetylu (DMAD) do pirydyny przebiega przez związek pośredni obojnaczy w formalnej [2+2]cykloaddycji do cyklobutenu, a następnie do 1 ,3-tiazepina w 4-elektronowym pierścieniu elektrocyklicznym otwiera się, a następnie do 7-tia-2-azanorkaradienu w 6-elektronowym pierścieniu elektrocyklicznym, zamyka się przed wytłoczeniem atomu siarki.
Sole tiazoliowe
Alkilowanie tiazoli przy azocie tworzy kation tiazoliowy . Sole tiazoliowe są katalizatorami reakcji Stettera i kondensacji benzoiny . Deprotonowanie soli N- alkilotiazoliowych daje wolne karbeny i kompleksy karbenowe metali przejściowych .
Alagebrium to lek na bazie tiazolu .