Benzyloamina - Benzylamine

|
|
|
|
| Nazwy | |
|---|---|
|
Preferowana nazwa IUPAC
Fenylometanoamina |
|
| Inne nazwy
α-aminotoluen
benzyloamina fenylometyloamina |
|
| Identyfikatory | |
|
Model 3D ( JSmol )
|
|
| 741984 | |
| CZEBI | |
| CHEMBL | |
| ChemSpider | |
| DrugBank | |
| Karta informacyjna ECHA |
100.002.595 |
| Numer WE | |
| 49783 | |
| KEGG | |
|
Identyfikator klienta PubChem
|
|
| Numer RTECS | |
| UNII | |
| Numer ONZ | 2735 |
|
Pulpit nawigacyjny CompTox ( EPA )
|
|
|
|
|
|
| Nieruchomości | |
| C 7 H 9 N | |
| Masa cząsteczkowa | 107,156 g·mol -1 |
| Wygląd zewnętrzny | Bezbarwna ciecz |
| Zapach | słaby, przypominający amoniak |
| Gęstość | 0,981 g/ml |
| Temperatura topnienia | 10 °C (50 °F; 283 K) |
| Temperatura wrzenia | 185 ° C (365 ° F; 458 K) |
| Mieszalny | |
| Rozpuszczalność | mieszalny w etanolu , eterze dietylowym bardzo dobrze rozpuszczalny w acetonie rozpuszczalny w benzenie , chloroformie |
| Kwasowość (p K a ) | 9.34 |
| Zasadowość (p K b ) | 4,66 |
| -75,26 x 10 -6 cm 3 / mol | |
|
Współczynnik załamania ( n D )
|
1,543 |
| Struktura | |
| 1,38 D | |
| Zagrożenia | |
| Główne zagrożenia | Łatwopalny i żrący |
| Arkusz danych dotyczących bezpieczeństwa | Fischer Scientific |
| Piktogramy GHS |
 
|
| Hasło ostrzegawcze GHS | Zagrożenie |
| H302 , H312 , H314 | |
| P260 , P264 , P270 , P280 , P301+312 , P301+330+331 , P302+352 , P303+361+353 , P304+340 , P305+351+338 , P310 , P312 , P321 , P322 , P330 , P363 , P405 , P501 | |
| NFPA 704 (ognisty diament) | |
| Temperatura zapłonu | 65 ° C (149 ° F; 338 K) |
| Związki pokrewne | |
|
Powiązane aminy
|
anilina |
|
O ile nie zaznaczono inaczej, dane podano dla materiałów w ich stanie standardowym (przy 25 °C [77 °F], 100 kPa). |
|
|
|
|
| Referencje do infoboksu | |
Benzyloamina jest organicznym związkiem chemicznym o skondensowanym wzorze strukturalnym C 6 H 5 CH 2 NH 2 (czasami w skrócie Ph CH 2 NH 2 lub Bn NH 2 ). Składa się ona z benzylu grupę C 6 H 5 CH 2, przyłączony do aminowej grupy funkcyjnej , NH 2 . Ta bezbarwna, rozpuszczalna w wodzie ciecz jest powszechnym prekursorem w chemii organicznej i jest wykorzystywana w przemysłowej produkcji wielu farmaceutyków . Chlorowodorek sól stosowana w leczeniu choroby lokomocyjnej na Mercury-Atlas 6 misji, w których NASA astronauta John Glenn został pierwszym Amerykaninem na orbicie Ziemi.
Produkcja
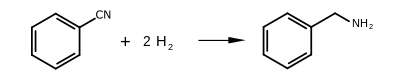
Benzyloaminę można wytwarzać kilkoma metodami, z których główną drogą przemysłową jest reakcja chlorku benzylu i amoniaku . Jest również wytwarzać przez redukcję benzonitrylu i redukcyjne aminowanie z benzaldehydu , jak odbywa się w obecności niklu Raney'a .
Po raz pierwszy został przypadkowo wytworzony przez Rudolfa Leuckarta w reakcji benzaldehydu z formamidem w procesie znanym obecnie jako reakcja Leuckarta , ogólnym procesie, w którym redukcyjne aminowanie aldehydów lub ketonów daje odpowiednią aminę .
Biochemia
Benzylamina powstaje biologicznie w wyniku działania N -podstawionego enzymu deformylazy formamidowej , który jest wytwarzany przez bakterie Arthrobacter pascens . Ta hydrolaza katalizuje konwersję N- benzyloformamidu do benzyloaminy z mrówczanem jako produktem ubocznym. Benzyloamina jest rozkładana biologicznie w wyniku działania enzymu monoaminooksydazy B , w wyniku czego powstaje benzaldehyd.
Zastosowania
Benzyloamina jest wykorzystywana jako maskowane źródło amoniaku , ponieważ po N - alkilacji grupa benzylowa może być usunięta przez hydrogenolizę :
- C 6 H 5 CH 2 NH 2 + 2 RBr → C 6 H 5 CH 2 NR 2 + 2 HBr
- C 6 H 5 CH 2 NR 2 + H 2 → C 6 H 5 CH 3 + R 2 NH
Zazwyczaj w pierwszym etapie do absorbowania HBr (lub pokrewnego kwasu dla innych rodzajów środków alkilujących) stosuje się zasadę.
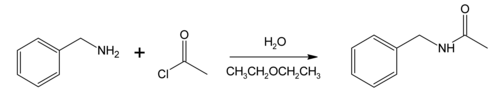
Benzyloamina reaguje z chlorkiem acetylu, tworząc N- benzyloacetamid, przykład reakcji Schottena-Baumanna opisanej po raz pierwszy w latach 80. XIX wieku. Reakcja zachodzi w dwufazowym układzie rozpuszczalników (tutaj woda i eter dietylowy ), dzięki czemu produkt uboczny chlorowodoru jest sekwestrowany w fazie wodnej (a czasami zobojętniany rozpuszczoną zasadą) i w ten sposób zapobiega się protonowaniu aminy i utrudnianiu postęp reakcji. Warunki te są często nazywane warunkami reakcji Schotten-Baumanna i mają bardziej ogólne zastosowanie. Ten konkretny przykład jest użyteczny jako model mechanizmu polimeryzacji międzyfazowej diaminy z chlorkiem dikwasu.
Izochinoliny są klasą związków ( benzopyridines ), które są stosowane w kontekstach (takich jak znieczulającego dimethisoquin , w przeciwnadciśnieniowego debriizochiny oraz rozszerzające naczynia papaweryny ), a w innych obszarach, (na przykład środek dezynfekujący N -laurylisoquinolinium bromek). Sama izochinolina jest wydajnie wytwarzana za pomocą reakcji Pomeranza-Fritscha , ale może być również wytwarzana z benzyloaminy i acetalu glioksalu za pomocą analogicznego podejścia znanego jako modyfikacja Schlittlera-Müllera do reakcji Pomeranza-Fritscha. Ta modyfikacja może być również wykorzystana do przygotowania podstawionych izochinolin.
Reakcji aza-Dielsa-Aldera przekształca imin i dienów do tetrahydropirydyny , w której atom azotu może być częścią dienów lub dienofilów . Imina jest często generowana in situ z aminy i formaldehydu . Przykładem jest reakcja cyklopentadienu z benzyloaminą z wytworzeniem azanorbornenu .
Benzylamina jest wykorzystywana w przemysłowym wytwórcy wielu farmaceutyków, w tym alniditanu , lakozamidu , moksyfloksacyny i nebiwololu . Jest również używany do produkcji heksanitroheksaazaizowurcytanu (HNIW), który jest lepszy od starszych nitroaminowych materiałów wybuchowych, takich jak HMX i RDX , chociaż jest mniej stabilny. US Navy testuje HNIW do stosowania paliw rakietowych , takich jak pociski , ponieważ ma mniejsze właściwości obserwowalność takich jak mniej widocznego dymu. HNIW wytwarza się najpierw kondensując benzyloaminę z glioksalem w acetonitrylu w warunkach kwaśnych i odwadniających. Cztery z grup benzylowych usuwa się z heksabenzyloheksaazaizowurcytanu przez hydrogenolizę katalizowaną przez pallad na węglu i powstałe drugorzędowe grupy aminowe acetyluje się w bezwodniku octowym . Otrzymany związek pośredni podstawiony dibenzylem poddaje się następnie reakcji z tetrafluoroboranem nitroniowym i tetrafluoroboranem nitrozoniowym w sulfolanie w celu wytworzenia HNIW.
Sole
Chlorowodorek sól benzyloaminy, C 6 H 5 CH 2 NH 3 Cl lub C 6 H 5 CH 2 NH 2 HCI, wytwarza się w reakcji benzyloaminy z kwasem solnym , i mogą być stosowane w leczeniu choroby lokomocyjnej . Astronauta NASA John Glenn otrzymał w tym celu chlorowodorek benzyloaminy na misję Mercury-Atlas 6 . Kation w tej soli nazywa się benzyloamoniowy i jest ugrupowaniem występującym w farmaceutykach, takich jak środek przeciwrobaczy hydroksynaftoesan befenu , stosowany w leczeniu glistnicy .
Wykazano, że inne pochodne benzyloaminy i jej soli mają właściwości przeciwwymiotne , w tym te z ugrupowaniem N- (3,4,5-trimetoksybenzoilo)benzyloaminy. Dostępne w handlu środki przeciw chorobie lokomocyjnej, w tym cynaryzyna i meklizyna, są pochodnymi benzyloaminy.
Inne benzyloaminy
1-fenyloetyloamina jest metylowaną pochodną benzyloaminy który chiralne ; formy enancjomeryczne uzyskuje się przez rozdzielanie racematów . Jego postać racemiczna jest czasami znana jako (±)-α-metylobenzyloamina. Zarówno benzyloamina, jak i 1-fenyloetyloamina tworzą trwałe sole amonowe i iminy ze względu na ich stosunkowo wysoką zasadowość .
Bezpieczeństwo i środowisko
Benzyloamina wykazuje niewielki toksyczność doustną u szczurów z LD 50 1130 mg / kg. Łatwo ulega biodegradacji.