Temperatura termodynamiczna - Thermodynamic temperature
| Termodynamika |
|---|

|
Temperatura termodynamiczna jest miarą temperatury bezwzględnej i jest jednym z podstawowych parametrów termodynamiki . Odczyt temperatury termodynamicznej wynoszący zero oznacza punkt, w którym zaczyna się podstawowa właściwość fizyczna, która nasyca materię temperaturą, przenoszoną energią kinetyczną w wyniku ruchu atomów. W nauce temperaturę termodynamiczną mierzy się w skali Kelvina, a jednostką miary jest kelwin (symbol jednostki: K). Dla porównania temperatura 295 K jest komfortowa, równa 21,85 °C i 71,33 °F.
W punkcie zerowym temperatury termodynamicznej, zera absolutnego , cząstki materii poruszają się w minimalnym stopniu i nie mogą się ochłodzić. Zero bezwzględne, które jest temperaturą zero kelwinów (0 K), jest dokładnie równe -273,15 °C i -459,67 °F. Materia w zerze absolutnym nie ma żadnej pozostałej możliwej do przeniesienia średniej energii kinetycznej, a jedyny pozostały ruch cząstek jest spowodowany zawsze wszechobecnym zjawiskiem mechaniki kwantowej zwanym energią punktu zerowego . Chociaż atomy na przykład w pojemniku z ciekłym helem, który był dokładnie w stanie zera absolutnego, nadal lekko się trzęsą z powodu energii punktu zerowego, teoretycznie doskonały silnik cieplny z takim helem, jak jeden z jego płynów roboczych, nigdy nie mógłby przenieść żadnej kinetyki netto. energię (energię cieplną ) do innego płynu roboczego i nie może wystąpić żadna praca termodynamiczna .
Temperatura jest zwykle wyrażana w wartościach bezwzględnych, gdy naukowo bada się wzajemne powiązania temperatury z pewnymi innymi właściwościami fizycznymi materii, takimi jak jej objętość lub ciśnienie (patrz prawo Gay-Lussaca ) lub długość fali emitowanego przez nią promieniowania ciała doskonale czarnego . Temperatura bezwzględna jest również przydatna przy obliczaniu szybkości reakcji chemicznych (patrz równanie Arrheniusa ). Ponadto temperatura bezwzględna jest zwykle stosowany w kriogenicznych i zjawisk pochodnych, takich jak nadprzewodnictwa , zgodnie z poniższym Przykładem wykorzystania „Korzystnie, temperaturę przejścia w tantalu ( T c ) od 4.4924 kelwin nieznacznie powyżej 4,2221 K temperatura wrzenia helu”.
Skala Kelvina jest również używana w życiu codziennym – często nie zdając sobie z tego sprawy – ze względu na kolorową fotografię filmową i zapotrzebowanie na filmy, które były zrównoważone dla dwóch rodzajów lamp studyjnych z żarnikiem wolframowym oraz południowego słońca. Ponieważ temperaturę obiektów emitujących promieniowanie ciała doskonale czarnego, takich jak słońce i żarniki wolframowe, od dawna mierzy się w kelwinach, temperatura barwowa oświetlenia fotograficznego – a nawet zwykłych żarówek LED do oświetlania pomieszczeń w dzisiejszych czasach – jest mierzona w kelwinach następujące przykładowe użycie: „Fotografowie, którzy nie posiadają miernika temperatury barwowej, mogą oświetlać swoje sceny zwykłymi żarówkami LED o temperaturze 3200 kelwinów (ciepła biel) i ustawić punkt bieli swoich cyfrowych aparatów fotograficznych na „ wolframowy” .”
Przegląd
Międzynarodowego Układu Jednostek Miar (SI) określa skali Kelvina pomiaru temperatury termodynamicznej, i jednostkę miary Kelvina (jednostki symbolu: K) dla określonych wartości wzdłuż skali. Kelwin jest również używany do oznaczania przedziałów temperatur (rozpiętości lub różnicy między dwiema temperaturami), zgodnie z następującym przykładem użycia: „Lut cynowo-ołowiowy 60/40 jest nieeutektyczny i jest plastyczny w zakresie 5 kelwinów w miarę krzepnięcia ”. Przedział temperatur jednego stopnia Celsjusza jest taki sam jak jeden kelwin.
Wielkość kelwina została przedefiniowana w 2019 r. w odniesieniu do samej właściwości fizycznej leżącej u podstaw temperatury termodynamicznej: energii kinetycznej ruchu cząstek atomowych. Redefinicja ustaliła dokładnie stałą Boltzmanna1,380 649 × 10 -23 dżuli na kelwin (J/K). Złożona jednostka miary dla stałej Boltzmanna jest często podawana jako J·K −1 , co może wydawać się abstrakcyjne ze względu na kropkę mnożenia ( · ) i symbol kelwina, po którym następuje ujemny wykładnik 1 w indeksie górnym , jednak jest to tylko kolejny składnia matematyczna oznaczająca tę samą miarę: dżule (jednostka SI energii , w tym energia kinetyczna) na kelwin.
Właściwość, która nasyca dowolną substancję temperaturą, można łatwo zrozumieć, badając prawo gazu doskonałego , które odnosi się, na podstawie stałej Boltzmanna, w jaki sposób energia cieplna powoduje dokładnie określone zmiany ciśnienia i temperatury niektórych gazów. Dzieje się tak, ponieważ gazy jednoatomowe, takie jak hel i argon, zachowują się kinetycznie jak doskonale elastyczne i sferyczne kule bilardowe, które poruszają się tylko w określonym podzbiorze możliwych ruchów wibracyjnych, które mogą wystąpić w materii: obejmującym trzy translacyjne stopnie swobody . Translacyjne stopnie swobody to znane ruchy kuli bilardowej w osiach X, Y i Z przestrzeni 3D (patrz Rys. 1 poniżej). To dlatego wszystkie gazy szlachetne mają taką samą pojemność cieplną na atom i dlatego ta wartość jest najniższa ze wszystkich gazów.
Cząsteczki (dwa lub więcej chemicznie związanych atomów) mają jednak strukturę wewnętrzną, a zatem mają dodatkowe wewnętrzne stopnie swobody (patrz rys. 3 poniżej), co powoduje, że cząsteczki absorbują więcej energii cieplnej przy dowolnym wzroście temperatury niż gazy jednoatomowe. Energia cieplna rodzi się we wszystkich dostępnych stopniach swobody; jest to zgodne z twierdzeniem o ekwipartycji , więc wszystkie dostępne wewnętrzne stopnie swobody mają taką samą temperaturę jak ich trzy zewnętrzne stopnie swobody. Jednak właściwość, która nadaje wszystkim gazom ich ciśnienie , która jest siłą wypadkową na jednostkę powierzchni na pojemnik, powstającą w wyniku odrzucania z niego cząstek gazu, jest funkcją energii kinetycznej przenoszonej w trzech translacyjnych stopniach swobody atomów i cząsteczek .
Ustalenie stałej Boltzmanna na określoną wartość, wraz z tworzeniem innych reguł, skutkowało precyzyjnym ustaleniem wielkości jednostkowego przedziału temperatury termodynamicznej, kelwina, w odniesieniu do średniego zachowania kinetycznego gazów szlachetnych. Ponadto, punkt początkowy termodynamicznej skali temperatury, zero bezwzględne, został ponownie potwierdzony jako punkt, w którym w próbce pozostaje zerowa średnia energia kinetyczna ; jedynym pozostałym ruchem cząstki jest ten, który zawiera losowe wibracje spowodowane energią punktu zerowego.
Skala Rankine'a
Chociaż w historii istniało wiele innych skal temperatury , były tylko dwie skale do pomiaru temperatury termodynamicznej, gdzie zero absolutne jest ich punktem zerowym (0): skala Kelvina i skala Rankine'a .
W całym świecie naukowym, w którym nowoczesne pomiary są prawie zawsze wykonywane przy użyciu Międzynarodowego Układu Jednostek, temperaturę termodynamiczną mierzy się w skali Kelvina. Skala Rankine'a jest częścią angielskich jednostek inżynieryjnych w Stanach Zjednoczonych i znajduje zastosowanie w niektórych dziedzinach inżynierii, zwłaszcza w starszych pracach referencyjnych. Skala Rankine'a wykorzystuje stopień Rankine'a (symbol: °R) jako jednostkę, która jest taka sama jak stopień Fahrenheita (symbol: °F).
Przyrost jednostki o jeden stopień Rankine'a jest dokładnie 1,8 razy mniejszy niż jeden kelwin; tak więc, aby przeliczyć określoną temperaturę ze skali Kelvina na skalę Rankine'a, K × 1,8 = °R , oraz przeliczyć temperaturę ze skali Rankine'a na skalę Kelvina, °R / 1,8 = K . W konsekwencji zero bezwzględne wynosi „0” dla obu skal, ale temperatura topnienia lodu wodnego (0 °C i 273,15 K) wynosi 491,67 °R.
Aby przeliczyć przedziały temperatur (zakres lub różnicę między dwiema temperaturami), używa się tych samych wzorów z poprzedniego akapitu; na przykład zakres 5 kelwinów jest dokładnie równy zakresowi 9 stopni Rankine'a.
Nowoczesna redefinicja kelwina
Przez 65 lat, między 1954 a 2019 redefinicją jednostek podstawowych SI , przedział temperatury jednego kelwina był definiowany jako1/273,16różnica między punktem potrójnym wody a zerem absolutnym. Rezolucja Międzynarodowego Biura Miar i Wag z 1954 r. (znana pod francuskim akronimem BIPM) oraz późniejsze rezolucje i publikacje określiły punkt potrójny wody jako dokładnie 273,16 K i przyznały, że „powszechną praktyką” jest akceptacja tego ze względu na poprzednie konwencje (mianowicie, że 0 °C od dawna definiowano jako temperaturę topnienia wody i że od dawna eksperymentalnie określono punkt potrójny wody jako nierozróżnialnie bliski 0,01 °C), różnica między skalą Celsjusza i Skala Kelvina jest akceptowana jako 273,15 Kelvina; co oznacza, że 0 °C równa się 273,15 kelwina. Wynik netto tego, jak i późniejszych rozwiązań, był dwojaki: 1) zdefiniowali zero absolutne jako dokładnie 0 K i 2) zdefiniowali, że punkt potrójny specjalnie kontrolowanej wody izotopowej, zwanej wiedeńską standardową średnią oceaniczną wodą, miał dokładnie 273,16 kelwina i 0,01 °C. Jednym z efektów wspomnianych rezolucji było to, że temperatura topnienia wody, choć bardzo bliska 273,15 kelwina i 0 °C, nie była wartością definiującą i podlegała udoskonaleniu za pomocą bardziej precyzyjnych pomiarów.
Standard BIPM z 1954 r. wykonał dobrą robotę, ustalając — w ramach niepewności wynikających z różnic izotopowych między próbkami wody — temperatury wokół punktu zamarzania i punktu potrójnego wody, ale wymagał, aby wartości pośrednie między punktem potrójnym a zerem absolutnym, a także wartości ekstrapolowane od temperatury pokojowej i poza nią, do ustalenia eksperymentalnie za pomocą aparatury i procedur w poszczególnych laboratoriach. Wadę tę rozwiązano w Międzynarodowej Skali Temperatury z 1990 r. , czyli ITS‑90, która zdefiniowała 13 dodatkowych punktów, od 13,8033 K do 1357,77 K. Choć ITS‑90 jest definicyjny, miał – i nadal ma – pewne wyzwania, częściowo dlatego, że osiem jego ekstrapolowane wartości zależą od temperatur topnienia lub zamarzania próbek metali, które muszą pozostać wyjątkowo czyste, aby nie wpłynąć na ich temperatury topnienia lub zamarzania — zwykle obniżone.
Redefinicja jednostek bazowych SI w 2019 roku miała na celu przede wszystkim oddzielenie wielu podstaw definicyjnych systemu SI od kilograma , który był ostatnim fizycznym artefaktem definiującym jednostkę podstawową SI (cylindry platynowo-irydowe przechowywane w trzech zagnieżdżonych słojach w sejf znajdujący się we Francji) i który miał bardzo wątpliwą stabilność. Rozwiązanie wymagało, aby cztery stałe fizyczne, w tym stała Boltzmanna, były definitywnie ustalone.
Przypisanie stałej Boltzmanna precyzyjnie określonej wartości nie miało praktycznego wpływu na współczesną termometrię poza najdoskonalszymi pomiarami. Przed redefinicją punkt potrójny wody wynosił dokładnie 273,16 K i 0,01 ° C, a stała Boltzmanna została eksperymentalnie określona jako1,380 649 03 (51) × 10 −23 J/K , gdzie „(51)” oznacza niepewność w dwóch najmniej znaczących cyfrach (03) i odpowiada względnej niepewności standardowej równej 0,37 ppm. Następnie, definiując stałą Boltzmanna jako dokładnie1380 649 × 10 -23 J/K , niepewność 0,37 ppm została przeniesiona do punktu potrójnego wody, która stała się wartością wyznaczoną eksperymentalnie 273,1600 ±0,0001 K (0,0100 ±0,0001°C). To, że punkt potrójny wody zakończył się bardzo blisko 273,16 K po redefinicji SI nie był przypadkiem; ostateczna wartość stałej Boltzmanna została określona częściowo dzięki sprytnym eksperymentom z argonem i helem, które wykorzystywały punkt potrójny wody jako kluczową temperaturę odniesienia.
Pomimo redefinicji z 2019 r., ogniwa trójpunktowe z wodą nadal służą w nowoczesnej termometrii jako niezwykle precyzyjne wzorce kalibracyjne w temperaturze 273,16 K i 0,01 °C. Co więcej, punkt potrójny wody pozostaje jednym z 14 punktów kalibracyjnych składających się na ITS‑90, który rozciąga się od punktu potrójnego wodoru (13,8033 K) do punktu zamarzania miedzi (1 357,77 K), co stanowi prawie stukrotny zakres termodynamiki. temperatura.
Związek temperatury, ruchów, przewodzenia i energii cieplnej

Charakter energii kinetycznej, ruchu postępowego i temperatury
Temperatura termodynamiczna dowolnej ilości substancji w masie (statystycznie istotna ilość cząstek) jest wprost proporcjonalna do średniej średniej energii kinetycznej określonego rodzaju ruchu cząstek, znanego jako ruch translacyjny. Te proste ruchy w trzech wymiarach przestrzeni X, Y i Z oznaczają, że cząstki poruszają się w trzech przestrzennych stopniach swobody . Ta szczególna forma energii kinetycznej jest czasami nazywana temperaturą kinetyczną. Ruch postępowy jest tylko jedną z form energii cieplnej, która nadaje gazom nie tylko ich temperaturę, ale także ciśnienie i zdecydowaną większość ich objętości. Ta zależność pomiędzy temperaturą, ciśnieniem i objętością gazów jest określona przez wzór prawa gazu doskonałego pV = nRT i jest zawarta w prawach gazu .
Chociaż energia kinetyczna przenoszona wyłącznie w trzech translacyjnych stopniach swobody obejmuje temperaturę termodynamiczną substancji, cząsteczki, jak widać na ryc. 3 , mogą mieć inne stopnie swobody, z których wszystkie należą do trzech kategorii: długość wiązania, kąt wiązania i rotacyjny. Wszystkie trzy dodatkowe kategorie niekoniecznie są dostępne dla wszystkich cząsteczek, a nawet dla cząsteczek, które mogą doświadczyć wszystkich trzech, niektóre mogą zostać „zamrożone” poniżej pewnej temperatury. Niemniej jednak wszystkie te stopnie swobody, które są dostępne dla cząsteczek w określonym zestawie warunków, przyczyniają się do właściwej pojemności cieplnej substancji; to znaczy, że zwiększają ilość ciepła (energii kinetycznej) wymaganej do podniesienia danej ilości substancji o jeden kelwin lub jeden stopień Celsjusza.
Zależność energii kinetycznej, masy i prędkości wyraża wzór E k = 1/2w . 2 . W związku z tym cząstki o jednej jednostce masy poruszające się z jedną jednostką prędkości mają dokładnie taką samą energię kinetyczną i dokładnie taką samą temperaturę, jak cząstki o masie cztery razy większej, ale o połowie prędkości.
Stopień, w jakim energia kinetyczna ruchu translacyjnego w statystycznie istotnym zbiorze atomów lub cząsteczek gazu wpływa na ciśnienie i objętość tego gazu, jest proporcjonalną funkcją temperatury termodynamicznej określonej przez stałą Boltzmanna (symbol: k B ) . Stała Boltzmanna wiąże również temperaturę termodynamiczną gazu ze średnią energią kinetyczną ruchu translacyjnego poszczególnych cząstek w następujący sposób:
gdzie:
- jest średnią energią kinetyczną każdej pojedynczej cząstki, w dżulach (J)
- k B =1,380 649 × 10 −23 J/K
- T jest temperaturą termodynamiczną objętości substancji w stopniach Kelvina (K)
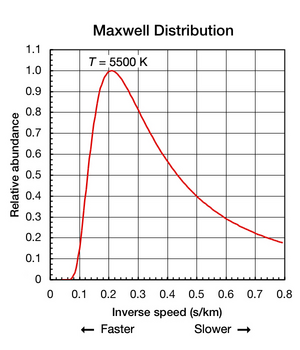
Chociaż stała Boltzmanna jest przydatna do znalezienia średniej energii kinetycznej w próbce cząstek, ważne jest, aby pamiętać, że nawet gdy substancja jest izolowana i znajduje się w równowadze termodynamicznej (wszystkie części mają jednolitą temperaturę i żadne ciepło nie wchodzi ani nie wychodzi z it), ruchy translacyjne poszczególnych atomów i cząsteczek występują w szerokim zakresie prędkości (patrz animacja na ryc. 1 powyżej). W dowolnym momencie proporcja cząstek poruszających się z określoną prędkością w tym zakresie jest określana przez prawdopodobieństwo opisane przez rozkład Maxwella-Boltzmanna . Wykres przedstawiony na rys. 2 pokazuje rozkład prędkości 5500 K atomów helu. Mają najbardziej prawdopodobną prędkość 4,780 km/s (0,2092 s/km). Jednak pewna część atomów w danej chwili porusza się szybciej, podczas gdy inne poruszają się stosunkowo wolno; niektóre są chwilowo w wirtualnym bezruchu (poza osią x w prawo). Ten wykres wykorzystuje odwrotną prędkość dla swojej osi x, dzięki czemu kształt krzywej można łatwo porównać z krzywymi na rys. 5 poniżej. Na obu wykresach zero na osi x reprezentuje nieskończoną temperaturę. Dodatkowo oś x i y na obu wykresach są proporcjonalnie skalowane.
Wysokie prędkości ruchu postępowego
Chociaż do bezpośredniego wykrywania ruchów translacyjnych wymagany jest bardzo wyspecjalizowany sprzęt laboratoryjny, powstałe zderzenia atomów lub cząsteczek z małymi cząsteczkami zawieszonymi w płynie wytwarzają ruchy Browna, które można zobaczyć za pomocą zwykłego mikroskopu. Ruchy translacyjne cząstek elementarnych są bardzo szybkie, a do ich bezpośredniej obserwacji wymagane są temperatury bliskie zeru bezwzględnego . Na przykład, kiedy naukowcy z NIST osiągnęli rekordową temperaturę 700 nK (miliardowych części kelwina) w 1994 roku, użyli optycznego sprzętu laserowego do adiabatycznego chłodzenia atomów cezu . Następnie wyłączyli lasery pułapkujące i bezpośrednio zmierzyli prędkość atomów 7 mm na sekundę, aby obliczyć ich temperaturę. W poniższym przypisie podano wzory na obliczanie prędkości i prędkości ruchu postępowego.

Nie jest trudno wyobrazić sobie ruchy atomów wywołane temperaturą kinetyczną, ani rozróżnić między takimi ruchami a ruchami wywołanymi energią punktu zerowego. Rozważmy następujący hipotetyczny eksperyment myślowy, jak pokazano na rys. 2.5 po lewej, z atomem, który jest niezmiernie bliski zera absolutnego. Wyobraź sobie, że patrzysz przez zwykły mikroskop optyczny o mocy 400, co stanowi prawie maksymalne praktyczne powiększenie dla mikroskopów optycznych. Takie mikroskopy na ogół zapewniają pola widzenia o średnicy nieco ponad 0,4 mm. W centrum pola widzenia znajduje się pojedynczy lewitujący atom argonu (argon stanowi około 0,93% powietrza), który jest oświetlony i świecący na ciemnym tle. Gdyby ten atom argonu znajdował się na poziomie jednej bilionowej kelwina powyżej zera bezwzględnego i poruszał się prostopadle do pola widzenia w prawo, potrzebowałby 13,9 sekundy, aby przejść od środka obrazu do 200-mikronowy kleszcz; ta odległość podróży jest mniej więcej taka sama jak szerokość kropki na końcu tego zdania na nowoczesnych monitorach komputerowych. Gdy atom argonu powoli się poruszał, wahania położenia spowodowane energią punktu zerowego byłyby znacznie mniejsze niż rozdzielczość 200 nanometrów (0,002 mm) mikroskopu optycznego. Co ważne, prędkość translacyjna atomu wynosząca 14,43 mikrona na sekundę stanowi całą jego zachowaną energię kinetyczną, ponieważ nie znajduje się dokładnie w zera absolutnym. Gdyby atom znajdował się dokładnie w zerze absolutnym, niedostrzegalne przepychanie spowodowane energią punktu zerowego spowodowałoby, że bardzo nieznacznie błądziłby, ale atom byłby wiecznie umieszczony, średnio, w tym samym miejscu w polu widzenia. Jest to analogiczne do łodzi, która miała wyłączony silnik i teraz lekko podskakuje na stosunkowo spokojnych i bezwietrznych wodach oceanu; mimo że łódź losowo dryfuje w tę iz powrotem, pozostaje w tym samym miejscu na dłuższą metę i nie porusza się po wodzie. W związku z tym atom, który znajdowałby się dokładnie w zerze absolutnym, nie byłby „nieruchomy”, a jednak statystycznie istotny zbiór takich atomów miałby zerową energię kinetyczną netto dostępną do przeniesienia do dowolnego innego zbioru atomów. Dzieje się tak, ponieważ niezależnie od temperatury kinetycznej drugiego zbioru atomów, one również doświadczają skutków energii punktu zerowego. Takie są konsekwencje mechaniki statystycznej i natury termodynamiki.
Ruchy wewnętrzne cząsteczek i energia wewnętrzna

Jak wspomniano powyżej, istnieją inne sposoby poruszania się cząsteczek poza trzema translacyjnymi stopniami swobody, które nasycają substancje ich temperaturą kinetyczną. Jak widać na animacji po prawej, cząsteczki są złożonymi obiektami; są populacją atomów, a mieszanie termiczne może nadwyrężyć ich wewnętrzne wiązania chemiczne na trzy różne sposoby: poprzez obrót, długość wiązania i ruchy kąta wiązania; są to wszystkie rodzaje wewnętrznych stopni swobody . To sprawia, że cząsteczki różnią się od substancji jednoatomowych (składających się z pojedynczych atomów), takich jak gazy szlachetne hel i argon , które mają tylko trzy translacyjne stopnie swobody (oś X, Y i Z). Energia kinetyczna jest magazynowana w wewnętrznych stopniach swobody cząsteczek, co nadaje im wewnętrzną temperaturę. Mimo że ruchy te nazywane są „wewnętrznymi”, zewnętrzne części cząsteczek wciąż się poruszają – podobnie jak podskakiwanie nieruchomego balonu z wodą . Pozwala to na dwukierunkową wymianę energii kinetycznej między ruchami wewnętrznymi i ruchami translacyjnymi przy każdym zderzeniu cząsteczek. W związku z tym, gdy energia wewnętrzna jest usuwana z cząsteczek, zarówno ich temperatura kinetyczna (energia kinetyczna ruchu postępowego), jak i ich temperatura wewnętrzna jednocześnie zmniejszają się w równych proporcjach. Zjawisko to jest opisane przez twierdzenie ekwipartycji , które mówi, że dla dowolnej ilości substancji w równowadze energia kinetyczna ruchu cząstki jest równomiernie rozłożona na wszystkie aktywne stopnie swobody dostępne dla cząstek. Ponieważ temperatura wewnętrzna cząsteczek jest zwykle równa ich temperaturze kinetycznej, rozróżnienie to jest zwykle interesujące tylko przy szczegółowym badaniu zjawisk nielokalnej równowagi termodynamicznej (LTE), takich jak spalanie , sublimacja ciał stałych i dyfuzja gorących gazów w częściowej próżni.
Energia kinetyczna zmagazynowana wewnętrznie w cząsteczkach powoduje, że substancje zawierają więcej energii cieplnej w danej temperaturze i absorbują dodatkową energię wewnętrzną przy danym wzroście temperatury. Dzieje się tak, ponieważ jakakolwiek energia kinetyczna, która jest w danej chwili związana z ruchami wewnętrznymi, nie przyczynia się w tym samym momencie do ruchów translacyjnych molekuł. Ta dodatkowa energia kinetyczna po prostu zwiększa ilość energii wewnętrznej pochłanianej przez substancję przy danym wzroście temperatury. Ta właściwość jest znana jako specyficzna pojemność cieplna substancji .
Różne cząsteczki absorbują różne ilości energii wewnętrznej dla każdego przyrostowego wzrostu temperatury; oznacza to, że mają różne pojemności cieplne właściwe. Wysoka pojemność cieplna powstaje po części dlatego, że cząsteczki pewnych substancji mają więcej wewnętrznych stopni swobody niż inne. Na przykład azot w temperaturze pokojowej , który jest cząsteczką dwuatomową , ma pięć aktywnych stopni swobody: trzy obejmują ruch translacyjny plus dwa obrotowe stopnie swobody wewnętrznie. Nic dziwnego, że zgodnie z twierdzeniem o ekwipartycji azot ma pięć trzecich pojemności cieplnej na mol (określoną liczbę cząsteczek), podobnie jak gazy jednoatomowe. Innym przykładem jest benzyna (patrz tabela pokazująca jej właściwą pojemność cieplną). Benzyna może pochłaniać dużą ilość energii cieplnej na mol przy niewielkiej zmianie temperatury, ponieważ każda cząsteczka zawiera średnio 21 atomów, a zatem ma wiele wewnętrznych stopni swobody. Nawet większe, bardziej złożone cząsteczki mogą mieć dziesiątki wewnętrznych stopni swobody.
Dyfuzja energii cieplnej: entropia, fonony i ruchome elektrony przewodnictwa

Przewodzenie ciepła to dyfuzja energii cieplnej z gorących części systemu do zimnych części. System może być pojedynczą jednostką zbiorczą lub wieloma dyskretnymi jednostkami zbiorczymi. Termin masa w tym kontekście oznacza statystycznie istotną ilość cząstek (która może być mikroskopijną ilością). Ilekroć energia cieplna dyfunduje w izolowanym systemie, różnice temperatur w systemie maleją (iwzrasta entropia ).
Jeden szczególny mechanizm przewodzenia ciepła występuje, gdy ruch translacyjny, ruch cząstek leżący u podstaw temperatury, przenosi pęd z cząstki na cząstkę w zderzeniach. W gazach te ruchy translacyjne mają charakter pokazany powyżej na Rys. 1 . Jak widać na tej animacji, nie tylko pęd (ciepło) rozchodzi się w całej objętości gazu poprzez seryjne zderzenia, ale całe cząsteczki lub atomy mogą poruszać się naprzód na nowe terytorium, niosąc ze sobą swoją energię kinetyczną. W konsekwencji różnice temperatur bardzo szybko wyrównują się w gazach — zwłaszcza w przypadku lekkich atomów lub cząsteczek; konwekcja jeszcze bardziej przyspiesza ten proces.
Ruch postępowy w ciałach stałych przybiera jednak postać fononów (patrz rys. 4 po prawej). Fonony to ograniczone, skwantowane paczki fal, które poruszają się z prędkością dźwięku danej substancji. Sposób, w jaki fonony oddziałują w ciele stałym, determinuje różne jego właściwości, w tym przewodność cieplną. W elektrycznie izolujących ciałach stałych przewodzenie ciepła oparte na fononie jest zwykle nieefektywne i takie ciała stałe są uważane za izolatory termiczne (takie jak szkło, plastik, guma, ceramika i skała). Dzieje się tak, ponieważ w ciałach stałych atomy i cząsteczki są zablokowane w miejscu względem swoich sąsiadów i nie mogą swobodnie wędrować.
Metale nie ograniczają się jednak tylko do przewodzenia ciepła opartego na fononach. Energia cieplna przewodzi przez metale niezwykle szybko, ponieważ zamiast bezpośrednich zderzeń cząsteczka-cząsteczka, zdecydowana większość energii cieplnej jest przekazywana przez bardzo lekkie, ruchome elektrony przewodzące . Właśnie dlatego istnieje prawie idealna korelacja między przewodnością cieplną metali a ich przewodnością elektryczną . Elektrony przewodzące nasycają metale swoją niezwykłą przewodnością, ponieważ są zdelokalizowane (tzn. nie są związane z konkretnym atomem) i zachowują się raczej jak rodzaj gazu kwantowego ze względu na efekt energii punktu zerowego (więcej o ZPE, patrz Uwaga 1 poniżej ). Ponadto elektrony są stosunkowo lekkie, a ich masa spoczynkowa wynosi tylko 1 ⁄ 1836 masy protonu . Jest to mniej więcej taki sam stosunek jak krótki pocisk .22 (29 ziaren lub 1,88 g ) w porównaniu do karabinu, który nim strzela. Jak pisał Isaac Newton ze swoją trzecią zasadą ruchu :
Prawo #3: Wszystkie siły występują parami, a te dwie siły są równe co do wielkości i przeciwne w kierunku.
Jednak pocisk przyśpiesza szybciej niż karabin przy jednakowej sile. Ponieważ energia kinetyczna rośnie wraz z kwadratem prędkości, prawie cała energia kinetyczna trafia do pocisku, a nie do karabinu, mimo że obie jednostki doświadczają tej samej siły z rozprężających się gazów miotających. W ten sam sposób, ponieważ są one znacznie mniej masywne, energia cieplna jest łatwo przenoszona przez ruchome elektrony przewodzące. Dodatkowo, ponieważ są one zdelokalizowane i bardzo szybkie, kinetyczna energia cieplna bardzo szybko przewodzi przez metale z dużą ilością elektronów przewodzących.
Dyfuzja energii cieplnej: promieniowanie ciała doskonale czarnego

Promieniowanie cieplne jest produktem ubocznym zderzeń powstających w wyniku różnych ruchów wibracyjnych atomów. Te zderzenia powodują, że elektrony atomów emitują fotony termiczne (znane jako promieniowanie ciała doskonale czarnego ). Fotony są emitowane za każdym razem, gdy ładunek elektryczny jest przyspieszany (jak to ma miejsce, gdy zderzają się chmury elektronowe dwóch atomów). Nawet pojedyncze cząsteczki o temperaturze wewnętrznej większej niż zero bezwzględne również emitują promieniowanie ciała doskonale czarnego ze swoich atomów. W każdej masie substancji w stanie równowagi fotony ciała doskonale czarnego są emitowane w zakresie długości fal w widmie, które ma kształt podobny do krzywej dzwonowej, zwany krzywą Plancka (patrz wykres na ryc. 5 po prawej). Szczyt krzywej Plancka ( szczytowa długość fali emitancji ) znajduje się w określonej części widma elektromagnetycznego w zależności od temperatury ciała doskonale czarnego. Substancje w ekstremalnych temperaturach kriogenicznych emitują na długich falach radiowych, podczas gdy ekstremalnie gorące temperatury wytwarzają krótkie promienie gamma (patrz Tabela powszechnych temperatur ).
Promieniowanie ciała doskonale czarnego rozprasza energię cieplną w całej substancji, ponieważ fotony są pochłaniane przez sąsiednie atomy, przenosząc w tym procesie pęd. Fotony ciała doskonale czarnego również łatwo uciekają z substancji i mogą być absorbowane przez otaczające środowisko; w procesie traci się energię kinetyczną.
Zgodnie z prawem Stefana-Boltzmanna intensywność promieniowania ciała doskonale czarnego wzrasta wraz z czwartą potęgą temperatury bezwzględnej. Tak więc ciało doskonale czarne o temperaturze 824 K (niewiele mniej niż świecące matowoczerwone) emituje 60-krotnie większą moc promieniowania niż w temperaturze 296 K (temperatura pokojowa). To dlatego tak łatwo można odczuć promieniujące ciepło od gorących przedmiotów z daleka. W wyższych temperaturach, takich jak te występujące w lampie żarowej , promieniowanie ciała doskonale czarnego może być głównym mechanizmem, dzięki któremu energia cieplna ucieka z układu.
Tabela temperatur termodynamicznych
Pełny zakres termodynamicznej skali temperatury, od zera bezwzględnego do bezwzględnego gorąca, a niektóre godne uwagi punkty między nimi pokazano w poniższej tabeli.
| kelwin |
Emitancja szczyt fali od fotonów ciała czarnego |
|
|
Zero absolutne (dokładnie z definicji) |
0 tys | ∞ |
| Najzimniejsza zmierzona temperatura |
450 pK | 6400 km |
| Jeden milikelwin (dokładnie z definicji) |
0,001 tys | 2.897 77 m (radio, pasmo FM ) |
|
Kosmiczne mikrofalowe promieniowanie tła |
2,725 tys | 1,063 mm (szczytowa długość fali) |
| Woda jest potrójny punkt | 273,16 tys | 10.6083 µm (długość fali IR ) |
|
Standardowa temperatura ISO 1 dla precyzyjnej metrologii (dokładnie 20 °C z definicji) |
293,15 tys |
9,884 95 µm (długość fali IR ) |
| Lampa żarowa | 2500 tys | 1,16 µm (bliska podczerwień ) |
| Widoczna powierzchnia słońca | 5778 tys | 501,5 nm ( zielone światło ) |
|
Kanał błyskawicy |
28 000 tys | 100 nm ( światło dalekiego ultrafioletu ) |
| Jądro Słońca | 16 MK | 0,18 nm ( promienie rentgenowskie ) |
|
Wybuch termojądrowy (temperatura szczytowa) |
350 MK | 8,3 × 10-3 nm ( promienie gamma ) |
| Maszyna Z Sandia National Labs |
2 GK | 1,4 × 10-3 nm (promienie gamma) |
| Jądro gwiazdy o dużej masie w jej ostatnim dniu |
3 GK | 1 × 10-3 nm (promienie gamma) |
| Scalanie binarnego układu gwiazd neutronowych |
350 zł | 8 × 10-6 nm (promienie gamma) |
| Przodkowie rozbłysku gamma | 1 TK | 3 × 10-6 nm (promienie gamma) |
|
Zderzenia protonów z jądrami w CERN-ie |
10 TK | 3 × 10-7 nm (promienie gamma) |
| Wszechświat 5,391 × 10 −44 s po Wielkim Wybuchu |
1,417 x 10 32 K |
1,616 × 10 -26 nm (częstotliwość Plancka) |
Ciepło przemian fazowych
Energia kinetyczna ruchu cząstek jest tylko jednym z elementów całkowitej energii cieplnej substancji; innym są przejścia fazowe , które są potencjalną energią wiązań molekularnych, które mogą tworzyć się w substancji podczas jej ochładzania (np. podczas kondensacji i zamrażania ). Energia cieplna wymagana do przejścia fazowego nazywana jest ciepłem utajonym . Zjawisko to można łatwiej uchwycić, rozpatrując je w odwrotnym kierunku: ciepło utajone to energia potrzebna do zerwania wiązań chemicznych (np. podczas parowania i topienia ). Prawie każdy zna skutki przejść fazowych; na przykład para o temperaturze 100°C może spowodować poważne oparzenia znacznie szybciej niż powietrze z suszarki do włosów o temperaturze 100°C . Dzieje się tak, ponieważ duża ilość utajonego ciepła jest uwalniana, gdy para skrapla się na skórze w ciekłą wodę.
Chociaż energia cieplna jest uwalniana lub pochłaniana podczas przemian fazowych, czyste pierwiastki chemiczne , związki i stopy eutektyczne nie wykazują żadnych zmian temperatury podczas ich przechodzenia (patrz rys. 7 poniżej po prawej). Rozważ jeden szczególny rodzaj przejścia fazowego: topienie. Kiedy ciało stałe topi się, wiązania chemiczne sieci krystalicznej są rozrywane; substancja przechodzi z tak zwanego stanu bardziej uporządkowanego do stanu mniej uporządkowanego . Na ryc. 7 topnienie lodu pokazano w lewym dolnym polu przechodzącym od niebieskiego do zielonego.
W jednym konkretnym punkcie termodynamicznym, temperaturze topnienia (który w przypadku wody wynosi 0°C w szerokim zakresie ciśnień), wszystkie atomy lub cząsteczki znajdują się średnio na maksymalnym progu energetycznym, w którym ich wiązania chemiczne mogą wytrzymać bez zrywania z kraty. Wiązania chemiczne są siłami typu wszystko albo nic: albo trzymają się mocno, albo pękają; nie ma stanu pośredniego. W konsekwencji, gdy substancja znajduje się w punkcie topnienia, każdy dżul dodanej energii cieplnej rozrywa wiązania tylko określonej ilości jej atomów lub cząsteczek, przekształcając je w ciecz o dokładnie tej samej temperaturze; żadna energia kinetyczna nie jest dodawana do ruchu translacyjnego (co daje substancjom ich temperaturę). Efekt jest podobny do popcornu : w określonej temperaturze dodatkowa energia cieplna nie może podgrzać ziaren, dopóki przejście (popping) nie zostanie zakończone. Jeśli proces jest odwrócony (jak w przypadku zamrażania cieczy), energia cieplna musi zostać usunięta z substancji.
Jak wspomniano powyżej, energia cieplna wymagana do przejścia fazowego nazywana jest ciepłem utajonym. W szczególnych przypadkach topnienia i zamrażania nazywa się to entalpią topnienia lub ciepłem topnienia. Jeśli wiązania molekularne w sieci krystalicznej są silne, ciepło topnienia może być stosunkowo duże, zwykle w zakresie od 6 do 30 kJ na mol dla wody i większości pierwiastków metalicznych. Jeśli substancja jest jednym z gazów jednoatomowych (które mają niewielką tendencję do tworzenia wiązań molekularnych), ciepło topnienia jest skromniejsze i wynosi od 0,021 do 2,3 kJ na mol. Relatywnie mówiąc, przejścia fazowe mogą być prawdziwie energetycznymi wydarzeniami. Aby całkowicie stopić lód o temperaturze 0 °C w wodę o temperaturze 0 °C, należy dodać około 80-krotność energii cieplnej, jaka jest wymagana do podniesienia temperatury tej samej masy wody w stanie ciekłym o jeden stopień Celsjusza. Proporcje metali są jeszcze większe, zwykle w zakresie od 400 do 1200 razy. A przejście fazowe wrzenia jest znacznie bardziej energetyczne niż zamrażanie. Na przykład energia wymagana do całkowitego zagotowania lub odparowania wody (co jest znane jako entalpia parowania ) jest około 540 razy większa niż wymagana do wzrostu o jeden stopień.
Spora entalpia parowania wody powoduje, że skóra może ulec spaleniu tak szybko, jak para się na niej skrapla (od czerwonego do zielonego na Rys. 7 powyżej). W przeciwnym kierunku, dlatego jeden za czuje skóry ochłodzenia w ciekłej wodzie (w wyparowuje w procesie, który zachodzi na niższym otoczenia temperatura termometru wilgotnego , który jest zależny od wilgotności względnej ). Wysokoenergetyczna entalpia parowania wody jest również ważnym czynnikiem leżącym u podstaw tego, dlaczego słoneczne przykrycia basenowe (pływające, izolowane koce, które przykrywają baseny, gdy nie są używane) są tak skuteczne w obniżaniu kosztów ogrzewania: zapobiegają parowaniu. Na przykład odparowanie zaledwie 20 mm wody z basenu o głębokości 1,29 m chłodzi wodę o 8,4 stopnia Celsjusza (15,1 °F).
Energia wewnętrzna
Całkowita energia wszystkich ruchów translacyjnych i wewnętrznych cząstek, w tym elektronów przewodzących, plus energia potencjalna zmian fazowych, plus energia punktu zerowego, składają się na energię wewnętrzną substancji.

Energia wewnętrzna przy zerze absolutnym
Gdy substancja ochładza się, różne formy energii wewnętrznej i związane z nimi efekty jednocześnie zmniejszają się: ciepło utajone dostępnych przejść fazowych jest uwalniane, gdy substancja przechodzi ze stanu mniej uporządkowanego do stanu bardziej uporządkowanego; ruchy translacyjne atomów i cząsteczek maleją (spada ich temperatura kinetyczna); ruchy wewnętrzne cząsteczek maleją (spada ich temperatura wewnętrzna); elektrony przewodzące (jeśli substancja jest przewodnikiem elektrycznym) poruszają się nieco wolniej; a szczytowa długość fali emitancji promieniowania ciała doskonale czarnego wzrasta (energia fotonów maleje). Gdy cząstki substancji są jak najbliżej całkowitego spoczynku i zachowują jedynie ruch kwantowo-mechaniczny wywołany przez ZPE, substancja znajduje się w temperaturze zera absolutnego ( T = 0).

Należy zauważyć, że podczas gdy zero bezwzględne jest punktem zerowej temperatury termodynamicznej i jest również punktem, w którym cząstki materii poruszają się w minimalnym stopniu, zero bezwzględne niekoniecznie jest punktem, w którym substancja zawiera zerową energię wewnętrzną; trzeba być bardzo precyzyjnym, co rozumie się przez energię wewnętrzną . Często wszystkie zmiany fazy, która może występować w substancji, będą miały miejsce do czasu, gdy osiągnie zero bezwzględne. Jednak nie zawsze tak jest. Warto zauważyć, że hel T = 0 pozostaje ciekły pod ciśnieniem pokojowym ( Rys. 9 po prawej) i musi być pod ciśnieniem co najmniej 25 barów (2,5 MPa ), aby wykrystalizować. Dzieje się tak, ponieważ ciepło topnienia helu (energia wymagana do stopienia lodu helowego) jest tak niskie (tylko 21 dżuli na mol), że wywołujący ruch efekt energii punktu zerowego jest wystarczający, aby zapobiec zamarzaniu przy niższym ciśnieniu.
Kolejną komplikacją jest to, że wiele ciał stałych zmienia swoją strukturę krystaliczną na bardziej zwarte układy pod ekstremalnie wysokim ciśnieniem (do milionów barów lub setek gigapaskali). Są one znane jako przejścia fazowe ciało stałe-ciało stałe, w których ciepło utajone jest uwalniane, gdy sieć krystaliczna zmienia się w bardziej korzystną pod względem termodynamicznym, zwartą.
Powyższe zawiłości sprawiają, że dość kłopotliwe są ogólne stwierdzenia dotyczące energii wewnętrznej w substancjach T = 0. Niezależnie od ciśnienia można jednak powiedzieć, że przy zerach absolutnych wszystkie ciała stałe o sieci krystalicznej o najniższej energii, takie jak najbardziej upakowane układy (patrz rys. 8, powyżej z lewej), zawierają minimalną energię wewnętrzną, zachowując tylko tę należną. do wszechobecnego tła energii punktu zerowego. Można również powiedzieć, że dla danej substancji przy stałym ciśnieniu zero bezwzględne jest punktem najniższej entalpii (miara potencjału pracy uwzględniająca energię wewnętrzną, ciśnienie i objętość). Wreszcie, zawsze można powiedzieć, że wszystkie substancje o T = 0 zawierają zerową kinetyczną energię cieplną.
Praktyczne zastosowania temperatury termodynamicznej
Temperatura termodynamiczna jest przydatna nie tylko dla naukowców, może być również przydatna dla laików w wielu dyscyplinach związanych z gazami. Wyrażając zmienne w wartościach bezwzględnych i stosując prawo proporcjonalności temperatury do ciśnienia Gay-Lussaca , rozwiązania codziennych problemów są proste; na przykład obliczanie, jak zmiana temperatury wpływa na ciśnienie wewnątrz opony samochodowej. Jeżeli w oponie ciśnienie skrajne wynosi 200 kPa , to jej ciśnienie bezwzględne wynosi 300 kPa. Temperatura w pomieszczeniu („zimna” w kategoriach opony) wynosi 296 K. Jeśli temperatura opony jest o 20 °C wyższa (20 kelwinów), rozwiązanie oblicza się jako316 tys/296 tys = 6,8% wyższa temperatura termodynamiczna i ciśnienie bezwzględne; to jest ciśnienie bezwzględne 320 kPa, które jest nadciśnieniem 220 kPa.
Związek z prawem gazu doskonałego
Temperatura termodynamiczna jest ściśle powiązana z prawem gazu doskonałego i jego konsekwencjami. Można to powiązać także z drugą zasadą termodynamiki. Można wykazać, że temperatura termodynamiczna ma specjalne właściwości, a w szczególności można zauważyć, że jest ona jednoznacznie zdefiniowana (aż do pewnego stałego współczynnika mnożnikowego), biorąc pod uwagę sprawność wyidealizowanych silników cieplnych . Tak więc stosunek t 2 / T 1 dwóch temperaturach T 1 i T 2 jest taka sama we wszystkich skalach bezwzględnych.
Ściśle mówiąc, temperatura układu jest dobrze określona tylko wtedy, gdy jest w równowadze termicznej . Z mikroskopijnego punktu widzenia, materiał znajduje się w równowadze termicznej, jeśli ilość ciepła między jego poszczególnymi cząstkami znosi się. Istnieje wiele możliwych skal temperatury, wywodzących się z różnych obserwacji zjawisk fizycznych.
Krótko mówiąc, różnice temperatur dyktują kierunek ciepła między dwoma systemami, tak aby ich łączna energia była maksymalnie rozłożona między ich najniższymi możliwymi stanami. Nazywamy ten rozkład „ entropią ”. Aby lepiej zrozumieć związek między temperaturą a entropią, rozważ relację między ciepłem, pracą i temperaturą zilustrowaną w silniku cieplnym Carnota . Konwertuje silnik cieplny do pracy, kierując się gradient temperatury między źródłem ciepła o wyższej temperaturze, T, H , i dolny element chłodzący, temperatura T, C , poprzez wypełnioną gazem tłoka. Praca wykonana w jednym cyklu jest równy różnicy między ciepła dostarczanego do silnika przez T, H , q H , a ciepło dostarczane T C przez silnik, Q C . Sprawność silnika jest praca podzielona przez put ciepła do systemu lub
|
|
|
( 1 ) |
gdzie jest praca wykonywana na cykl. Zatem sprawność zależy tylko od q C / q H .
Twierdzenie Carnota mówi, że wszystkie silniki odwracalne działające między tymi samymi zbiornikami ciepła są równie wydajne. W ten sposób, każdy odwracalna maszyna cieplna działa w zakresie temperatur T 1 i T 2 musi mieć taką samą wydajność, to znaczy, że wydajność jest funkcją tylko temperatury
|
|
|
( 2 ) |
Ponadto, odwracalne roboczych silnika ciepło od temperatury T 1 i T 3 musi mieć taką samą skuteczność jak jeden składa się z dwóch cykli jednego między T 1 i drugiej (pośredniej) temperatura T 2 , a drugi między T 2 i T 3 . Gdyby tak nie było, wówczas energia (w postaci Q ) zostanie zmarnowana lub zyskana, co skutkuje różnymi ogólnymi sprawnościami za każdym razem, gdy cykl zostanie podzielony na cykle składowe; oczywiście cykl może składać się z dowolnej liczby mniejszych cykli.
Z takim rozumieniem Q 1 , Q 2 i Q 3 , matematycznie,
Ale pierwsza funkcja NIE jest funkcją T 2 , dlatego iloczyn dwóch końcowych funkcji MUSI skutkować usunięciem T 2 jako zmiennej. Jedynym sposobem jest zatem zdefiniowanie funkcji f w następujący sposób:
oraz
aby
tj. stosunek wymiany ciepła jest funkcją odpowiednich temperatur, w których one występują. Możemy wybrać dowolną funkcję monotoniczną dla naszego ; to kwestia wygody i konwencji, którą wybieramy . Wybierając następnie jedną stałą temperaturę odniesienia (tj. punkt potrójny wody), ustalamy termodynamiczną skalę temperatury.
Taka definicja pokrywa się z definicją wyprowadzenia gazu doskonałego; ponadto jest to definicja termodynamicznej temperatury, która pozwala nam stanowią sprawności cyklu Carnota, w zakresie T H i T C , a tym samym uzyskania że (kompletna) cykl Carnota jest izentropowa:
|
|
|
( 3 ) |
Podstawiając to z powrotem do naszego pierwszego wzoru na wydajność, otrzymujemy zależność pod względem temperatury:
|
|
|
( 4 ) |
Zauważ, że dla T C =0 sprawność wynosi 100%, a sprawność staje się większa niż 100% dla T C <0, co jest nierealne. Odjęcie prawej strony równania 4 od części środkowej i zmiana układu daje
gdzie znak ujemny wskazuje ciepło wyrzucane z systemu. Uogólnieniem tego równania jest twierdzenie Clausiusa , które sugeruje istnienie funkcji stanu (tj. funkcji, która zależy tylko od stanu układu, a nie od tego, jak osiągnął ten stan) zdefiniowanej (do stałej addytywnej) przez
|
|
|
( 5 ) |
gdzie indeks dolny wskazuje na wymianę ciepła w procesie odwracalnym. Funkcja odpowiada entropii układu, o której wspomniano wcześniej, a zmiana wokół dowolnego cyklu wynosi zero (co jest konieczne dla każdej funkcji stanu). Równanie 5 można zmienić, aby uzyskać alternatywną definicję temperatury w kategoriach entropii i ciepła (aby uniknąć pętli logicznej, powinniśmy najpierw zdefiniować entropię za pomocą mechaniki statystycznej):
Dla układu, w którym entropia jest funkcją jego energii , temperatura termodynamiczna jest zatem dana wzorem
tak, że odwrotnością temperatury termodynamicznej jest tempo wzrostu entropii z energią.
Historia
1702-1703: Guillaume Amontons (1663-1705) opublikował dwie prace, które mogą być wykorzystane do uznania go za pierwszego badacza, który wydedukował istnienie fundamentalnej (termodynamicznej) skali temperatury zawierającej zero absolutne. Dokonał tego odkrycia, starając się ulepszyć stosowane wówczas termometry powietrzne. Jego termometry typu J-tube składały się z kolumny rtęciowej, która była podtrzymywana przez stałą masę powietrza uwięzioną w części czujnikowej termometru. W kategoriach termodynamicznych jego termometry opierały się na relacji objętość/temperatura gazu pod stałym ciśnieniem. Jego pomiary temperatury wrzenia wody i temperatury topnienia lodu wykazały, że niezależnie od masy powietrza uwięzionego w jego termometrach lub ciężaru rtęci, jaką utrzymywało powietrze, zmniejszenie objętości powietrza w punkcie lodu było zawsze tym samym stosunkiem . Ta obserwacja doprowadziła go do wniosku, że wystarczająca redukcja temperatury zmniejszyłaby objętość powietrza do zera. W rzeczywistości jego obliczenia przewidywały, że zero bezwzględne odpowiadało -240 °C - tylko 33,15 stopnia mniej od prawdziwej wartości -273,15 °C. Odkrycie Amontona relacji jeden do jednego między temperaturą absolutną a ciśnieniem absolutnym zostało ponownie odkryte sto lat później i spopularyzowane w środowisku naukowym przez Josepha Louisa Gay-Lussaca . Dziś ta zasada termodynamiki jest powszechnie znana jako prawo Gay-Lussaca, ale znana jest również jako prawo Amontona .
1742: Anders Celsius (1701-1744) stworzył „odwróconą” wersję współczesnej skali temperatury Celsjusza. W oryginalnej skali Celsjusza zero oznaczało temperaturę wrzenia wody, a 100 oznaczało temperaturę topnienia lodu. W swoim artykule Obserwacje dwóch trwałych stopni na termometrze opisał swoje eksperymenty pokazujące, że ciśnienie nie miało wpływu na temperaturę topnienia lodu. Z niezwykłą precyzją określił również, jak zmienia się temperatura wrzenia wody w funkcji ciśnienia atmosferycznego. Zaproponował, że zero na jego skali temperatury (temperatura wrzenia wody) byłoby skalibrowane przy średnim ciśnieniu barometrycznym na średnim poziomie morza.
1744: Zbiega się ze śmiercią Andersa Celsjusza, słynny botanik Carl Linnaeus (1707-1778) skutecznie odwrócił skalę Celsjusza po otrzymaniu swojego pierwszego termometru ze skalą, gdzie zero oznaczało temperaturę topnienia lodu, a 100 oznaczało temperaturę wrzenia wody. Wykonany na zamówienie termometr linneuszowy do użytku w jego szklarniach został wykonany przez Daniela Ekströma, czołowego wówczas szwedzkiego producenta przyrządów naukowych. Przez następne 204 lata środowiska naukowe i termometryczne na całym świecie określały tę skalę jako skalę stopniową . Temperatury na skali stopni celsjusza były często podawane po prostu jako stopnie lub, gdy pożądana była większa specyficzność, stopnie Celsjusza . Symbolem wartości temperatury na tej skali był °C (w kilku formatach na przestrzeni lat). Ponieważ określenie celsjusza było również francuskojęzyczną nazwą jednostki miary kąta (jedna setna kąta prostego) i miało podobne konotacje w innych językach, termin „ stopień setny ” był używany w przypadku bardzo precyzyjnego, jednoznacznego języka. wymagane przez międzynarodowe organy normalizacyjne, takie jak Międzynarodowe Biuro Miar i Wag ( Bureau international des poids et mesures ) (BIPM). Dziewiąta Konferencja Generalna ds. Wag i Miar ( Conférence générale des poids et mesures ) oraz CIPM ( Międzynarodowy Komitet Miar ( Comité international des poids et mesures ) formalnie przyjęły stopień Celsjusza (symbol: °C) w 1948 roku.
1777: W swojej książce Pyrometrie (Berlin: Haude & Spener , 1779) ukończonej cztery miesiące przed śmiercią, Johann Heinrich Lambert (1728-1777), czasami błędnie określany jako Joseph Lambert, zaproponował bezwzględną skalę temperatury opartą na ciśnieniu/temperaturze zależność stałej objętości gazu. Różni się to od relacji objętość/temperatura gazu pod stałym ciśnieniem, którą Guillaume Amontons odkrył 75 lat wcześniej. Lambert stwierdził, że zero absolutne to punkt, w którym prosta ekstrapolacja liniowa osiąga zerowe ciśnienie gazu i wynosi -270 °C.
Około 1787: Pomimo pracy Guillaume'a Amontonsa 85 lat wcześniej, Jacques Alexandre César Charles (1746-1823) często przypisuje się odkrycie, ale nie opublikowanie, że objętość gazu pod stałym ciśnieniem jest proporcjonalna do jego temperatury bezwzględnej. Wzór utworzył się V 1 / T 1 = V 2 / T 2 .
1802: Joseph Louis Gay-Lussac (1778-1850) opublikował pracę (w uznaniu niepublikowanych notatek laboratoryjnych Jacquesa Charlesa piętnaście lat wcześniej) opisującą, jak objętość gazu pod stałym ciśnieniem zmienia się liniowo wraz z jego bezwzględną (termodynamiczną) temperaturą. Takie zachowanie nazywa się Prawem Karola i jest jednym z praw dotyczących gazu . Są to pierwsze znane wzory wykorzystujące liczbę 273 do określenia współczynnika rozszerzalności gazu w stosunku do temperatury topnienia lodu (wskazując, że zero bezwzględne było równoważne -273 ° C).
1848: William Thomson (1824-1907), znany również jako Lord Kelvin, napisał w swoim artykule On an Absolute Thermometric Scale , o potrzebie skali, w której nieskończone zimno (zero absolutne) było punktem zerowym skali, i która używała stopni Celsjusza dla przyrostu jednostki. Podobnie jak Gay-Lussac, Thomson obliczył, że zero absolutne odpowiadało -273 °C na ówczesnych termometrach powietrznych. Ta absolutna skala jest dziś znana jako termodynamiczna skala temperatury Kelvina. Warto zauważyć, że wartość Thomsona -273 została faktycznie wyprowadzona z 0,00366, co było akceptowanym współczynnikiem rozszerzalności gazu na stopień Celsjusza w stosunku do punktu lodu. Odwrotność -0,00366 wyrażona w pięciu cyfrach znaczących wynosi -273,22 °C, co jest niezwykle zbliżone do prawdziwej wartości -273,15 °C.
1859: Macquorn Rankine (1820-1872) zaproponował termodynamiczną skalę temperatury podobną do skali Williama Thomsona, ale używającą stopni Fahrenheita jako przyrostu jednostki. Ta bezwzględna skala jest dziś znana jako termodynamiczna skala temperatury Rankine'a .
1877-1884: Ludwig Boltzmann (1844-1906) wniósł duży wkład w termodynamikę poprzez zrozumienie roli, jaką odgrywała kinetyka cząstek i promieniowanie ciała doskonale czarnego. Jego nazwisko jest teraz przypisane do kilku wzorów stosowanych dzisiaj w termodynamice.
Około 1930: Eksperymenty z termometrią gazową starannie skalibrowane do temperatury topnienia lodu i temperatury wrzenia wody wykazały, że zero absolutne odpowiadało -273,15 °C.
1948: Rezolucja 3 9. CGPM (Conférence Générale des Poids et Mesures, znana również jako Generalna Konferencja Miar i Wag ) ustala punkt potrójny wody na dokładnie 0,01°C. W tym czasie punkt potrójny nadal nie miał formalnej definicji odpowiadającej mu wartości kelwinów, którą w rezolucji zadeklarowano „zostanie ustalona w późniejszym terminie”. Wynika z tego , że jeśli wartość zera absolutnego zmierzona w latach 30. XX wieku rzeczywiście wynosiła −273,15 °C, to punkt potrójny wody (0,01 °C) odpowiadał 273,16 K. Dodatkowo, zarówno CIPM (Comité international des poids et mesures , znany również jako Międzynarodowy Komitet Miar i Wag) i CGPM formalnie przyjęły nazwę Celsius dla stopni Celsjusza i skali temperatury Celsjusza .
1954: Rezolucja 3 10. CGPM nadała skali kelwina jej nowoczesną definicję, wybierając potrójny punkt wody jako górny punkt definiujący (bez zmiany na zero absolutne będące punktem zerowym) i przypisując mu temperaturę dokładnie 273,16 kelwina (co był w tym czasie napisany w 273,16 stopnia Kelvina ). To, w połączeniu z rozdzielczością 3 z 9. CGPM, spowodowało zdefiniowanie zera absolutnego jako dokładnie zero kelwinów i -273,15 °C.
1967/1968: Rezolucja 3 13. CGPM zmieniła nazwę jednostki przyrostu temperatury termodynamicznej kelwina , symbol K, zastępując stopień bezwzględny , symbol °K. Ponadto, uznając za przydatne bardziej wyraźne zdefiniowanie wielkości przyrostu jednostki, 13. CGPM również zdecydował w rezolucji 4, że „Kelwin, jednostka temperatury termodynamicznej, jest ułamkiem 1/273,16 temperatury termodynamicznej punktu potrójnego wody ”.
2005: CIPM (Comité International des Poids et Mesures, znany również jako Międzynarodowy Komitet Miar i Wag ) potwierdził, że dla celów określenia temperatury punktu potrójnego wody definicja termodynamicznej skali temperatury Kelvina odnosi się do woda o składzie izotopowym zdefiniowanym jako dokładnie równy nominalnej specyfikacji wiedeńskiej normy średniej wody oceanicznej .
2019: W listopadzie 2018 r. 26. Ogólna Konferencja Miar (CGPM) zmieniła definicję Kelvina, ustalając stałą Boltzmanna na1.380 649 x 10 -23 wyrażony w jednostkach J / K. Ta zmiana (i inne zmiany w definicji jednostek SI) weszła w życie w 144. rocznicę Konwencji Metrycznej, 20 maja 2019 r.
Zobacz też
- Zero absolutne
- Temperatura Hagedorna
- Proces adiabatyczny
- Stała Boltzmanna
- Silnik cieplny Carnota
- Sprawność konwersji energii
- Entalpia
- Entropia
- Twierdzenie o równoważności
- Fahrenheita
- Pierwsza zasada termodynamiki
- Zamrażanie
- Przepisy dotyczące gazu
- Międzynarodowy System Ilości
- ITS-90
- Prawo gazu doskonałego
- kelwin
- Prawa termodynamiki
- Rozkład Maxwella-Boltzmanna
- Rzędów wielkości (temperatura)
- Przejście fazowe
- Prawo Plancka promieniowania ciała doskonale czarnego
- Skala Rankine'a
- Specyficzna pojemność cieplna
- Standardowa zmiana entalpii topnienia
- Standardowa zmiana entalpii waporyzacji
- Temperatura
- Wzory przeliczania temperatury
- Promieniowanie cieplne
- Termodynamiczna beta
- Równania termodynamiczne
- Równowaga termodynamiczna
- Termodynamika
- Kategoria Termodynamika (lista artykułów)
- Kalendarium technologii silników cieplnych
- Kalendarium technologii pomiaru temperatury i ciśnienia
- Potrójny punkt
Uwagi
- W poniższych uwagach, gdziekolwiek równości liczbowe są pokazane w zwięzłej formie , na przykład1.854 87 (14) × 10 43 , dwie cyfry w nawiasach oznaczają niepewność przy 1-σ (1 odchylenie standardowe , 68% poziom ufności) w dwóch najmniej znaczących cyfrach znaczącej .
Zewnętrzne linki
- Energia punktu zerowego i pole punktu zerowego. Witryna internetowa z dogłębnymi objaśnieniami różnych efektów kwantowych. Bernard Haisch z Instytutu Kalfizyki .










































